牙龈卟啉单胞菌菌毛蛋白fimA基因在大肠杆菌中的融合表达和纯化(二)
5)金属螯合亲和层析用于蛋白质的复性
在基因工程技术中,表达的重组蛋白多以包涵体形式存在,蛋白质经常会错误折叠而丧失活性,这一难题长久以来都没有得到很好的解决。高浓度的变性剂可以溶解包涵体,然后控制变性剂除去的速度,有时需要添加适当的氧化/还原试剂,蛋白质可以逐步折叠复性。通常使用的复性方法有三种,分别是稀释复性、透析复性和层析复性。
(1)稀释复性:直接把溶解的蛋白质稀释于复性缓冲液中。这种方法操作简单,适于小规模使用,但只适于浓度极低的蛋白质复性,否则会有大量聚集体形成。
(2)透析复性:采用透析膜通过逐渐降低外透液浓度来控制变性剂去除速度。这种方法速度慢、耗时长,不适合大规模使用,有时易形成无活性蛋白聚集体。
(3)层析复性:使蛋白质可逆吸附在固相介质上,例如离子交换层析介质、金属螯合亲和层析介质等,可以避免伸展的多肽分子之间形成聚集体。金属螯合亲和层析(IMAC)是一种有效的纯化和复性蛋白质的层析方法。在高浓度变性剂存在的情况下,组氨酸尾仍旧具有吸附在金属螯合亲和层析介质上的能力,所以可在IMAC介质上同时实现复性与纯化[112-116]。蛋白质吸附在IMAC介质后,先逐步降低变性剂的浓度,使蛋白质折叠,然后提高咪唑浓度把折叠后的蛋白质洗脱出来。对于TNF蛋白,使用IMAC获得了90%的复性收率[73]。
2.6 小结
大肠杆菌系统由于其遗传学、生物化学和分子生物学方面已充分被人们了解而成为表达许多异源蛋白质的首选表达系统。在过去的20多年中,用各种载体系统在大肠杆菌中表达了数百种重组蛋白。融合标签不但可提高重组蛋白的产量,还可增强重组蛋白质的可溶性。融合标签技术的使重组蛋白质的纯化更加快速、简便。随着金属螯合亲和层析技术的不断发展和改进,目前,固定化金属螯合亲和层析技术已成为蛋白质,特别是基因重组蛋白和多肽分离纯化最有效的工具之一。
本课题组已成功构建了Pg菌毛蛋白fimA基因的原核表达质粒pET-15b-fimA,本研究在此基础上,拟将此质粒在大肠杆菌BL21(DE3)pLysS中表达,然后用固定化金属螯合亲和层析技术得到纯化的FimA蛋白,为下一步获取免疫血清、进一步研制具有实用价值的预防牙周炎的免疫疫苗提供实验基础。
3 实验一 fimA在大肠杆菌中的表达
3.1 实验材料与仪器
3.1.1 菌珠
1)大肠杆菌BL21(DE3)pLysS:北京天根生化科技有限公司。该菌株基因型为:F-,ompT,hsdSB(rB-mB-),dcm(DE3),gal,pLysS,Cam r,该菌珠所带pLysS具有氯霉素抗性。此质粒含有表达T7溶菌酶的基因,T7溶菌酶能降低目的基因的背景表达水平,但不干扰IPTG诱导的表达。适于毒性蛋白和非毒性蛋白的表达。
2)携带有pET-15b Vector和pET-15b-fimA的大肠杆菌TOP10(本课题组前期实验获得)。其中pET-15b Vector:原核表达载体,双链环状DNA,由5708 bp组成,含有可插入外源基因的多克隆位点(MCS)、Amp抗性基因、T7 lac、T7 promoter、lac operator、T7 terminator、N-末端His-Tag(6个组氨酸)。是一种组氨酸融合表达载体,这6个组氨酸标签便于用钴柱纯化或以抗组氨酸抗体筛选。pET-15b载体读框及多克隆位点见图3.1,其克隆、表达区见图3.2。
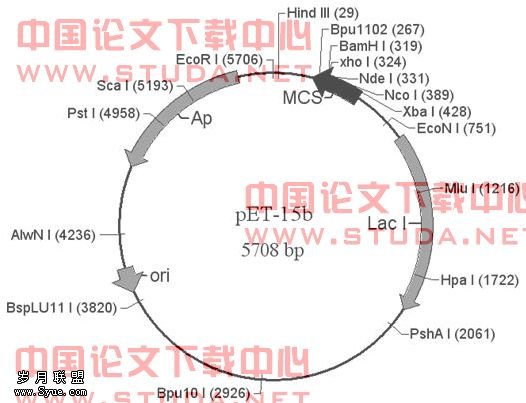
图3.1 原核表达载体质粒pET-15b图谱
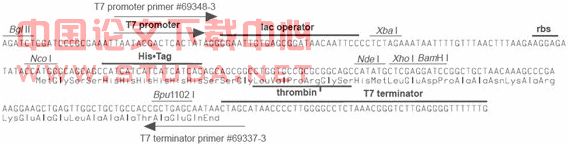
图3.2 pET-15b载体克隆、表达区
3.1.2 主要试剂
1)DNA Marker VI:北京天为时代科技有限公司
2)预染蛋白质MarkerⅢ:北京天根生化科技有限公司
3)细菌LB培养基(胰蛋白胨、酵母提取物):Promega公司
4)琼脂糖(Agarose):上海生工生物技术有限公司
5)琼脂粉(Agar powder):上海化学试剂公司
6)脱氧胆酸钠:上海亚培生物科技有限公司
7)丙烯酰胺、双丙烯酰胺、四甲基二乙胺(TEMED)、十二烷基磺酸钠(SDS)、二硫苏糖醇(DTT)、异丙基-β-D-硫代半乳糖苷(IPTG)、Tris碱、甘氨酸、溴酚蓝:Amresco USA
8)考马斯亮蓝(Brilliant Blue R-250):上海绿岛科技发展有限公司分装
9)ECL底物化学发光试剂盒:Pierce Biotechnology USA
10)质粒小提试剂盒:北京天为时代科技有限公司
11)硝酸纤维素膜(NC膜):浙江省台州市四甲生化厂
12)一抗(Anti-his antibody,小鼠单克隆抗体IgG2b):北京天根生化科技有限公司
13)二抗(Goat anti-Mouse IgG,(H+L),Perpxidase Conjugated):Pierce Biotechnology USA
14)脱脂奶粉:完达山乳业股份有限公司
15)其他生化试剂如溴化乙锭(EB)、冰醋酸、甲醇、过硫酸铵、无水乙醇、NaCl、CaCl2、MgCl2、氨苄青霉素、氯霉素等,均为进口或国产试剂
3.1.3 实验仪器
1)自动双重纯水蒸馏器SZ-93:上海亚荣生化仪器厂
2)超纯水设备Elix3+Mil-GB:法国Millipore公司
3)分析天平AA-250:Denver Instrument Company
4)恒温磁力搅拌器78HW-1:杭州仪表电机厂
5)电热恒温干燥箱PH030:上海市实验仪器厂有限公司
6)数控超声波清洗器KQ-500DE型:昆山市超声仪器有限公司
7)全自动高压灭菌锅HV-50:日本HIRAYAMA
8)塑料薄膜封口机SG-200型:上海凯明电子机械有限公司
9)紫外线消毒灯ZSZ:北京海淀空后高温复合材料厂
10)生物型洁净工作台BCM-1000A:苏净集团安泰公司
11)微量移液器Research单道/多道:Eppendorf
12)恒温培养箱HH.B11.420-BS:上海安亭
13)大型摇床QYC-211:上海福马实验设备有限公司
14)空气浴震荡器HZQ-C:哈尔滨市东明医疗器械厂
15)离心机(台式低速)TDL-40B:上海安亭仪器厂
16)离心机Sigma1-15(台式高速)和Sigma3K18(台式高速冷冻):Sigma
17)离心机(超微型)E-Centrifuge:Wealtec公司
18)微量振荡器ZW-A:江苏常州国华电器有限公司
19)石英定时器SDD-2型:北京市长风仪器仪表公司
20)电子恒温水浴锅DK-98-1:天津市泰斯特有限公司
21)精密DRY BLOCK加热器HGT24:T&D
22)酸度计420A:Thermo Orion
23)核酸电泳仪EPS-301:Amersham Biosciences
24)电泳槽DYCP-31D:北京六一
25)紫外可见光分光光度计Ultrospec 3300:Amersham Biosciences
26)凝胶成像系统Dolphin-Doc:Wealtec公司
27)台式电脑:联想
28)扫描仪ScanMaker 5900:中晶科技
29)冷冻干燥系统Lyph-Lock 12 Liter:Laboconco公司
30)普通冰箱NR-B22S1:无锡松下冷机有限公司
31)低温冰箱925型:Forma Scientific
32)STD3101-1蛋白电泳仪:Amersham Biosciences
33)Hoefer MiniVE Vertical Electrophoresis System:Amershem Biosciences USA
3.2 实验方法
3.2.1 从大肠杆菌Top10中提取质粒pET15b与pET-15b-fimA
从-70℃ 冰箱中取出携带有pET-15b和pET-15b-fimA的大肠杆菌TOP10菌珠,将细菌分别划线涂布于含Amp(100 μg/ml)的LB固体培养基平板上,倒置平板,37℃培养12~16 h后出现菌落。
从培养平板中挑选氨苄青霉素抗性菌落,分别接种入5m1 LB培养基中(含Amp l00 μg/m1),37℃ 振荡培养16 h,质粒小提试剂盒分别提取质粒DNA。步骤如下:
1)4℃,12000 r/min离心OD值超过0.6的菌液2ml,弃掉上清,倒扣在滤纸上流尽残余的上清。
2)加250 μl溶液P1,充分振荡混匀至彻底悬浮。
3)加250 μl溶液P2,温和的上下翻转6~8次使菌体充分裂解。此时菌液变得清亮粘稠,所用时间不应超过5 min。
4)加350 μl溶液P3,温和的上下翻转6~8次,充分混匀,此时会出现白色絮状沉淀,4℃,12000 r/min离心10 min,收集离心后得到的上清。
5)将上一步所得的上清加入吸附柱CB3中(吸附柱放入收集管中),12000 r/min离心30 s,弃去收集管中的废液。
6)加500 μl去蛋白液PD,12000 r/min离心30 s,弃掉废液。
7)加700 μl漂洗液PW(已加入无水乙醇),12000 r/min离心30 s,弃掉废液。
8)加500 μl漂洗液PW,12000 r/min离心30 s,弃掉废液。
9)将吸附柱CB3放回收集管中,12000 r/min离心2 min,尽量除去漂洗液。
10)取出吸附柱CB3,放入一个干净的离心管中,在吸附膜的中间部位加100 μl洗脱缓冲液EB(洗脱缓冲液事先在65~70℃水浴预热),室温放置15 min,12000 r/min离心1 min。将1.5 ml离心管(DNA溶液)于-70℃保存。
取5 µl质粒DNA,10 g/L TBE琼脂糖凝胶80 V、40 mA电泳检测DNA。设立marker对照。待溴酚蓝迁移至理想位置后,终止电泳,在紫外灯下观察拍照。
3.2.2 E.coli BL21(DE3)pLysS感受态细胞的制备
采用低温CaCl2制备感受态细胞的方法制备大肠杆菌E.coli BL21(DE3)pLysS感受态细胞。步骤如下:
1)从37℃培养16~20 h的平板上挑取一个单菌落(直径2~3 mm),转到一个含有50 ml LB液体培养基的250 ml锥形瓶中,37℃,220 r/min振摇培养3 ~4 h,至A600大约为0.6。
2)将细菌转移到一个高压灭菌、用冰预冷的50 ml聚丙烯管中,在冰上放置10 min,使培养物冷却至0℃。
3)4℃,4100 r/min离心10 min,以回收细胞。
4)倒出培养液,将管倒置1 min使最后的痕量培养液流尽。
5)用30 ml预冷的0.1 mol/L CaCl2-MgCl2溶液(80 mmol/L MgCl2 ,20 mmol/L CaCl2)重悬细胞沉淀。
6)4℃,4100 r/min离心10 min,以回收细胞。
7)倒出培养液,将管倒置1 min使最后的痕量培养液流尽。
8)用2 ml冰预冷的0.1 mol/L CaCl2溶液重悬细胞沉淀。
9)加入高压灭菌后的50%甘油,配成含甘油20%~25%的悬液,分装100 µl/支于eppendorf管中,-70℃冻存。
3.2.3 空质粒和重组质粒转化E.coli BL21(DE3)pLysS感受态细胞
1)制备含Amp(50 µg/m1)的15 g/L琼脂-LB固体培养基平板。
2)取冻存于-70℃的E.coli BL21(DE3)pLysS感受态细胞在流水下快速解冻(不可震动)。
3)将提取的空质粒和重组质粒各10 µl分别加入两支感受态细胞中,轻轻吹打混匀。
4)冰浴30 min后,置预热后的精密水浴锅42℃热休克90 s,立即移入冰水中放置2 min。
5)分别加入37℃预热后的LB液体培养基(不含抗生素)500 µl,37℃摇床150 r/min温和振摇60 min,使细胞复苏。
6)将离心管内容物混匀,分别吸取100 µl 已转化的感受态细胞加到两个含Amp(50 µg/m1)的15 g/L琼脂-LB固体培养基平板上,用无菌的弯头玻棒轻轻的将细胞均匀涂开。
7)将平板置于室温直至液体被吸收,倒置平板,37℃培养12~16 h。
3.2.4 从E.coli BL21(DE3)pLysS中提取质粒pET15b和pET-15b-fimA
从培养平板中挑选氨苄青霉素抗性菌落,分别接种入5 m1 LB培养基中(含Amp l00 μg/m1),37℃振荡培养16h,质粒小提试剂盒分别提取质粒DNA。步骤如3.2.1中所示。
取5 µl质粒DNA,10 g/L TBE琼脂糖凝胶80 V、40 mA电泳检测DNA。设立marker对照。待溴酚蓝迁移至理想位置后,终止电泳,在紫外灯下观察拍照。
3.2.5 重组质粒pET-15b-fimA在E.coli BL21(DE3)pLysS内的诱导表达
在转化了质粒pET15b和pET-15b-fimA的LB固体培养基上,各挑取一单克隆菌落,分别接种入1 ml Amp+(50 μg/ml)的LB液体培养基中,37℃,250 r/min振摇过夜。用LB培养基1:100稀释过夜菌(50 μl:5 ml),37℃剧烈振荡培养2 h,待菌液浓度达A5500.6~0.8时,加入异丙基-β-D-硫代半乳糖苷(IPTG),诱导的IPTG终浓度和诱导时间成梯度改变,以摸索最佳诱导条件:
A管:pET-15b-fimA,1 ml,加入IPTG致终浓度为2 mmol/L,30℃振摇3 h;
B管:pET-15b-fimA,1 ml,加入IPTG致终浓度为2 mmol/L,30℃振摇2 h;
C管:pET-15b-fimA,1 ml,加入IPTG致终浓度为2 mmol/L,30℃振摇1 h;
D管:pET-15b-fimA,1 ml,加入IPTG致终浓度为1 mmol/L,30℃振摇3 h;
E管:pET-15b-fimA,1 ml,加入IPTG致终浓度为1 mmol/L,30℃振摇2 h;
E管:pET-15b-fimA,1 ml,加入IPTG致终浓度为1 mmol/L,30℃振摇1 h;
F管:pET-15b,1 ml,加入IPTG致终浓度为2 mmol/L,30℃振摇3 h;
以上7个菌种管中菌液置于EP管中,4℃,12000 r/min离心5 min收集细菌沉淀,弃去上清;向沉淀中加入等体积的水和2×Loading buffer(SDS凝胶加样缓冲液),重悬后煮沸10 min,离心8 min;
取上清进行SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。
SDS-PAGE:配制12%分离胶和5%浓缩胶,按Amersham Biosciences公司蛋白电泳系统说明书灌制凝胶。取上述样品,每孔30 μ1上样。电泳在恒压下进行,浓缩胶中为90 V,分离胶中为120 V。电泳结束后,凝胶右下角做切角标记,然后将凝胶放入表面皿,加入5倍体积的考马斯亮蓝染色液(考马斯亮蓝R250 1.0 g,甲醇450 ml,冰醋酸100 ml,蒸馏水450 ml),35℃摇床上染色3 h。染色完成后,加入脱色液(甲醇100 ml,冰醋酸100 ml,蒸馏水800 ml),35℃摇床上脱色至背景清晰,观察。
3.2.6 蛋白免疫印迹(Western blot)鉴定蛋白的表达
在转化了质粒pET15b和pET-15b-fimA的LB固体培养基上,各挑取一单克隆菌落,分别接种入1 ml Amp+(50 μg/ml)的LB液体培养基中,37℃,250 r/min振摇过夜。用LB培养基1:100稀释过夜菌(50 μl:5 ml),37℃剧烈振荡培养2 h,待菌液浓度达A5500.6~0.8时,加入IPTG:
A管:pET-15b-fimA,1 ml,加入IPTG致终浓度为2 mmol/L,30℃振摇3 h;
B管:pET-15b,1 ml,加入IPTG致终浓度为2 mmol/L,30℃振摇3 h;
以上2个菌种管中菌液置于EP管中,4℃,12000 r/min离心5 min收集细菌沉淀,弃去上清;向沉淀中加入等体积的水和2×Loading buffer,重悬后煮沸10 min,离心8 min。
取上清进行SDS-PAGE,电泳结束后将凝胶切取所需条带部分后进行Western blot,具体步骤如下:
1)用转膜缓冲液平衡凝胶和硝酸纤维素膜(NC膜)30 min。
2)铺膜:将海绵在转膜缓冲液中完全浸润铺于阴极板,上铺三层用转膜缓冲液浸湿的滤纸,铺凝胶,铺NC膜,再铺三层滤纸,每层均需完全清除气泡,上面铺两层海绵,合上转印盒,内加转膜缓冲液高于海绵。
3)转印:电泳槽内加冰块,灌入转膜缓冲液,300 mA转印65 min。
4) 封闭:转印结束后,将NC膜放入封闭液(10 g脱脂奶粉溶于100 ml TBST中,煮沸冷却)中,液面必须过膜,摇床上轻摇4 h,保证膜的所有部分同溶液接触。
5)洗膜:弃去封闭液,TBST洗3次,每次15 min。
6)一抗结合:按照抗体说明书,用TBST将抗His标签的抗体稀释2000倍,弃去TBST,将膜放入一个自封袋内加一抗(0.1 ml/cm2膜面积)排出气泡,封口,4℃冰箱过夜。
7)洗膜:弃去一抗,TBST洗3次,每次15 min。
8)二抗结合:按照抗体说明书,用TBST将HRP标记的山羊抗鼠IgG稀释2000倍,弃去TBST,将膜放入一个自封袋内加二抗(0.1 ml/cm2膜面积)排出气泡,37℃恒温箱孵育1小时。
9)洗膜:弃去二抗,TBST洗3次,每次15 min。
10)用吸水纸吸干膜上的水分。
11)显色:按ECL底物化学发光试剂盒说明书配发光检测液,用吸管将配制的发光检测液转移到NC膜上,使其均匀覆盖,室温孵育5分钟。
11)暗室胶片曝光,显影,在胶片上显示目的条带:在暗室中取一张X片置于膜上,合上暗盒(暗盒上下各固定一张合适大小的发光纸,膜上下再各放置一张玻璃纸),曝光,显影,定影,晾干保存。 3.2.7 蛋白表达形式分析
1)取100ml 转化了pET-15b-fimA的大肠杆菌BL21(DE3)pLysS诱导菌液于预先称重的离心管中4℃,5500 r/min离心15 min。
*注意*:步骤2~4在4℃下进行。
2)弃去上清,称菌体沉淀的重量,每克(湿重)菌体加入3 ml细胞裂解缓冲液Ⅰ(50 mmol/L Tris-Cl pH 8.0,1 mmol/L EDTA pH 8.0,100 mmol/L NaCl),轻轻旋动或用磨光玻璃棒搅动,使菌体悬起。
3)每克(湿重)菌体加入4 µl 100 mmol/L PMSF,80 µl 10 mg/ml溶菌酶,搅动20 min。
4)每克(湿重)菌体加入4 mg脱氧胆酸钠,继续搅动。
5)悬液37℃放置,不时用玻璃棒搅动,待其变黏时,每克(湿重)菌体加入20 µl 1 mg/ml DNaseⅠ。
6)裂解液室温放置,直至不再黏稠(约30 min)。
7)细胞裂解液4℃高速离心15 min。
8)倾倒去除上清,留置待用,此为上清1,沉淀重悬于9倍体积的4℃细胞裂解缓冲液Ⅱ(50 mmol/L Tris-Cl pH 8.0,10 mmol/L EDTA pH 8.0,100 mmol/L NaCl,0.5%Triton-100)。
9)悬液室温放置5 min。
10)4℃高速离心15 min。
11)倾倒上清,留置待用,此为上清2。沉淀重悬于100 μ1水。
12)各取10 µl上清1、上清2、沉淀,分别与10 µl 2×SDS凝胶加样缓冲液(Loading Buffer)混合,用12%分离胶和5%浓缩胶SDS-PAGE分析靶蛋白的分布。
3.3结果 3.3.1 从E.coli Top10中提取质粒pET15b与pET-15b-fimA
电泳结果示(图3.3),在5500 bp附近和5500 bp~7000 bp之间各有一单一条带,与预期大小5708 bp和6755 bp一致。

图3.3 pET-15b和pET-15b-fimA质粒电泳图
1:pET-15b 2:pET-15b-fimA
M:Marker Ⅳ(从上到下7000,5500,3500,2000,1000,500 bp)
3.3.2 从E.coli BL21(DE3)pLysS中提取质粒pET15b和pET-15b-fimA
电泳结果示(图3.4)在5500 bp附近和5500 bp~7000 bp之间各有一单一条带,与预期大小5708 bp和6755 bp一致。

图3.4 pET-15b和pET-15b-fimA质粒电泳图
1:pET-15b 2:pET-15b-fimA
M:Marker Ⅳ(从上到下7000,5500,3500,2000,1000,500 bp)
3.3.3 重组质粒pET-15b-fimA的诱导表达分析
重组转化菌按前述程序经IPTG诱导表达后,在41 kDa处显示融合表达蛋白条带,而空质粒pET-15b在该处无特异条带(图3.5)。融合表达蛋白大小与预期大小基本一致,IPTG浓度及诱导时间对融合蛋白表达量影响较大:当IPTG浓度为2 mmol/L,诱导时间为3 h时蛋白表达量最大;当IPTG浓度为1 mmol/L,诱导时间为1 h时蛋白表达量最小。实验结果表明,牙龈卟啉单胞菌菌毛蛋白FimA的1044 bp编码基因在E.coli BL21(DE3)pLysS中已初步获得正确表达。
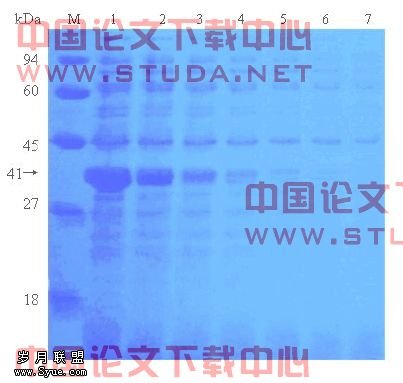
图3.5 pET-15b-fimA的诱导表达分析
1:pET-15b-fimA,2 mmol/L IPTG诱导3 h; 2:pET-15b-fimA,2 mmol/L IPTG诱导2 h;
3:pET-15b-fimA,2 mmol/L IPTG诱导1 h; 4:pET-15b-fimA,1 mmol/L IPTG诱导3 h;
5:pET-15b-fimA,1 mmol/L IPTG诱导2 h; 6:pET-15b-fimA,1 mmol/L IPTG诱导1 h;
7:pET-15b, 2 mmol/LIPTG诱导3 h; M:预染蛋白质MarkerⅢ
3.3.4蛋白免疫印迹(Western blot)的结果
融合表达的目的蛋白His-FimA带有His标签,因此,6×His-FimA表达产物经SDS-PAGE后,转移至硝酸纤维素膜,以鼠抗6×His Tag单克隆抗体为一抗,采用山羊抗鼠的种属特异性抗体为二抗,ECL底物化学发光试剂盒显色,在X线片上相应位置呈现阳性结果,可见一明显蛋白条带,而空质粒pET-15b对应位置未见特异条带(图3.6)。实验结果表明,重组质粒pET-15b-fimA在E.coli BL21(DE3)pLysS中获得正确表达。
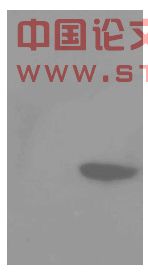
图3.6 融合蛋白表达产物的western blot鉴定
1:pET-15b 2:pET-15b-fimA
3.3.5 蛋白表达形式分析
诱导菌裂解后,分离上清(上清1)和沉淀(沉淀1),沉淀经处理后,将得到的上清(上清2)和沉淀(沉淀2)以及上清1一起走蛋白电泳分析,结果显示(图3.7),表达的融合蛋白位于沉淀中,主要以不溶性形式存在于包涵体中。
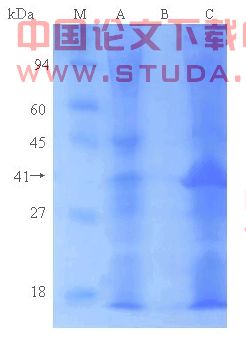
图3.7 FimA表达形式分析
A:上清2;B:上清1;C:包涵体沉淀
M:预染蛋白质MarkerⅢ
3.4 讨论
研究蛋白质的功能及制备抗体,必须获得目的蛋白。获得目的蛋白的途径有两种,一是利用蛋白的物理、化学特性从生物体内直接提取、纯化;另一种是利用基因工程技术构建表达载体,使目的基因在体外宿主细胞中大量表达目的蛋白。与直接从生物体内提取、纯化生物大分子相比,后一种技术既简便又高效。
基因工程又称重组DNA技术、遗传工程、分子克隆,指在体外对DNA分子按照既定的目的和方案进行剪切和重新连接,或将DNA分子中某个(些)位点进行人工替换或删除,改造基因结构,然后利用转化、转染、感染等方法将重组的DNA片段导入宿主细胞,使DNA片段得到扩增。将目的基因在受体细胞内表达,产生目的蛋白产物。基因工程为蛋白质的研究提供了极大方便,使那些表达量少,又难以纯化的蛋白质得以大规模制备,也使获得界并不存在的蛋白质成为可能[63,117]。
为使重组DNA在宿主中表达,有原核细胞表达外源基因和真核细胞表达外源基因两种体系。真核表达系统虽然有蛋白翻译后加工机会多, 甚至可被改造成人源型;真核细胞易被转染, 具有遗传稳定性和可重复性等优点,但是利用真核表达系统难以使基因得到高效表达。基因高效表达是一个非常复杂的问题,它受DNA拷贝数、转录有效性、mRNA的加工转运及稳定性、转译有效性以及蛋白质加工、分泌及稳定性等多方面因素的影响,而且高效表达不同基因之限速因素又不尽一致。目前,对真核生物基因表达的研究远远不如对原核生物的研究深入。其原因主要有:真核生物基因组成和形态结构复杂,难以直接测定基因产物和基因控制的生化过程;难以选择影响调控基因的突变体;难以通过改变外界环境条件来研究分析基因表达的变化;难以直接进行基因操作等。与真核表达系统相比,原核表达系统具有培养简单、迅速、、表达效率高、表达稳定和容易纯化等优点。大肠杆菌是最常用的原核表达体系,一个好的大肠杆菌表达体系应该满足以下几个标准[71]:①尽可能低的诱导前泄漏表达;②快速简便的诱导方式;③能够高效表达多种基因;④易于进行克隆操作;⑤能直接进行点突变和DNA序列分析而不要亚克隆,从而满足蛋白质工程研究的需要。
在现有实验条件和经济条件下,为了得到高表达量和生物学活性好的FimA蛋白,本实验选用原核表达载体pET-15b在原核表达体系大肠杆菌中进行融合表达。融合表达是将外源目的基因与另一基因构建成融合基因进行表达。该表达方式的特点有[71,118]:①由于转录和翻译的起始由正常的大肠杆菌序列所控制,因而融合蛋白通常较易获得高效表达。②外源序列与大肠杆菌基因的融合导致其融合蛋白通常较天然的外源蛋白稳定。另外融合蛋白表达也是纯化重组蛋白较简单易行的方法。
融合蛋白(fusion protein)是指表达的蛋白质或多肽的N末端由原核DNA编码,C末端是由克隆的真核DNA编码。这样表达的蛋白质由原核多肽和真核蛋白连接在一起,故称为融合蛋白。在表达融合蛋白时,为了得到正确编码的表达蛋白,在插入外源基因时,其阅读框架应与原核DNA片段的阅读框架一致,这样,插入的外源基因在翻译时才不致产生移码突变。融合蛋白具有极大的应用潜力[71]:①靶蛋白附着于已知酶功能和/或抗原组成的结构域,可以简化靶蛋白的标记与分离;②靶蛋白与信号肽连接,可以将融和蛋白分泌到特定的细胞区;③运载蛋白能保护靶蛋白免受原核宿主的蛋白酶解作用;④运载蛋白可以改善靶蛋白的溶解性,防止形成不溶性包涵体。
在前期实验中,本课题组将克隆的Pg的fimA基因片段连接入pET-15b原核融合表达载体,按正确的读框插入多克隆位点,成功的构建了重组质粒pET-15b-fimA。本实验将此重组质粒在大肠杆菌BL21(DE3)pLysS中诱导表达。表达产物经SDS-PAGE分析,在分子量为41 kDa处出现一条新生的蛋白带,与预期的融合蛋白大小相符。表达产物经Western blot分析,在X线片上相应位置呈现阳性结果,可见一明显蛋白条带,而空质粒pET-15b对应位置未见特异条带。这些实验结果说明fimA基因在大肠杆菌BL21(DE3)pLysS中得到了正确表达。
对于某一种特定蛋白质的表达,选择大肠杆菌系统时主要从以下几个方面考虑[71]:①蛋白质的大小:小的胞质蛋白和多肽(长度小于100个氨基酸残基)最好能通过标准肽键与运载序列连接,以融合蛋白的形式在大肠杆菌中表达。运载序列通常能起到稳定靶蛋白的作用,使其免受胞内蛋白酶的降解;并能提供用于亲和纯化的配基结合位点。用蛋白酶在融合蛋白的适当位点进行切割,可以回收到具有活性的靶蛋白。在任何系统中表达长度大于100个氨基酸残基的胞质蛋白质都非常困难。在大肠杆菌中,这些蛋白质常常不稳定而形成包涵体;在哺乳动物细胞中,困难在于如何将外源蛋白和它的内源同系物区分开来。②蛋白质的需要量:如果只需要少量的靶蛋白,比如筛选系列点突变蛋白寻找酶的活性位点,那么多数标准表达质粒都可以满足需要;而如果活性蛋白需要纯化和/或蛋白质的需要量很大,就有必要试验不同的宿主-载体系统和纯化方法,最终确定一个最适合大规模表达的方案。③蛋白质是否需要保留活性:如果表达靶蛋白的目的只是用于产生抗体,就不一定要获得活性蛋白,而可以选择便于靶蛋白纯化的表达系统,不管其是以活性形式还是变性状态存在,包涵体的形成对不溶性蛋白质的分离非常有利。如果靶蛋白是用于生物化学或细胞生物学研究,那么保持或恢复蛋白质的功能就非常重要,而是否易于纯化就是次要的了。有时表达产物本身就是活性的可溶性蛋白,而多数情况下表达产物是不溶的,必须经过从包涵体中纯化、溶解和再折叠才能恢复活性形式。如果表达蛋白是用于结构研究,最好能以可溶状态表达。
本实验所用的pET-15b载体属于pET载体系列。这类载体是Studier等于1990年首先构建的。在这种载体中,外源编码基因在多克隆位点插入,置于天然T7噬菌体RNA聚合酶启动子的控制之下,外源基因的表达受T7 RNA聚合酶调控。T7 RNA聚合酶的转录效率比大肠杆菌RNA聚合酶高5倍,能够高效转录mRNA、大量表达目的蛋白。T7 RNA聚合酶/启动子表达系统还有一个特点,就是需用不同的宿主菌进行外源基因的克隆和表达。特别是在外源基因表达产物是宿主菌的毒性蛋白时,在同一宿主菌进行克隆和表达会很困难,有时是不可能的。本课题组前期实验构建融合表达载体的过程中,用于克隆的宿主菌TOP10不表达T7 RNA聚合酶,宿主菌的其他RNA聚合酶不识别T7 RNA启动子,fimA基因得不到表达,不会对宿主菌造成影响,从而保证了fimA基因克隆的顺利进行。本实验用宿主菌大肠杆菌BL21(DE3)pLysS来表达fimA基因。由于正常大肠杆菌并不表达T7 RNA聚合酶,为了能利用T7启动子表达外源基因,研究者已将T7 RNA聚合酶置于lacUV5启动子的控制下,整合到大肠杆菌BL21(DE3)pLysS染色体中,从而能诱导表达T7 RNA聚合酶[63]。
本实验表达的His-FimA融合蛋白编码353个氨基酸(菌毛蛋白347个氨基酸,His标签6个氨基酸),在大肠杆菌BL21(DE3)pLysS进行表达时,经蛋白表达形式分析证实表达的融合蛋白位于包涵体中。蛋白质在大肠杆菌中的高水平表达,常常导致形成相差显微镜下可见的细胞质颗粒或包涵体。包涵体是由外源蛋白与周围杂蛋白或核酸等形成的不溶性的凝聚体,含大部分的表达蛋白。这些由表达蛋白聚集成的包涵体很容易与可溶性蛋白和膜蛋白分离。高水平表达外源蛋白的细菌经离心浓缩后,可通过机械法、超声处理法或溶菌酶加去污剂的方法进行裂解。包涵体经离心沉淀后可用Triton-100和EDTA或用尿素洗涤。洗涤的目的是尽可能从聚集的外源蛋白中除去可溶的、粘附的细菌蛋白。目前还不能预测外源蛋白在大肠杆菌中高水平表达时以可溶形式存在,还是聚集成包涵体。根据蛋白质的大小、疏水性和荷电性等,很难预见其表达状态。同时,根据天然蛋白的四级结构进行判断也是不可靠的,因为无论是单体蛋白还是寡聚体蛋白的亚基都能形成包涵体。
本实验中表达FimA蛋白的大肠杆菌BL21(DE3)pLysS经离心浓缩后,经含有Tris-Cl和EDTA的缓冲液重悬,然后用溶菌酶进行裂解。裂解后的细菌离心浓缩后,沉淀用含0.5%的Triton-100的缓冲液来洗涤。经SDS-PAGE分析,结果显示表达的融合蛋白主要位于沉淀中,以不溶形式存在于包涵体中。
影响基因在大肠杆菌中获得高水平表达的最重要因素可能是生长温度,通过实验确定最佳温度,是表达外源蛋白的关键。虽然在15~42℃之间都获得过成功表达,但表达某一种特定蛋白质的最佳温度范围则可能很窄,只有2~4℃。IPTG的浓度对表达水平影响非常大,1 mmol/L是一个起点,也是一个比较高的浓度。实验中,应在0.01~5.0 mmol/L的范围内改变IPTG的浓度,寻找最佳使用浓度。受实验条件限制,本实验在30℃,用2 mmol/L IPTG,3 h的条件来诱导靶蛋白的表达,靶蛋白能够得到正确的表达。如果条件允许,应该选择不同的温度、不同的IPTG浓度和时间来摸索最佳诱导条件,以达到最优的表达效果。