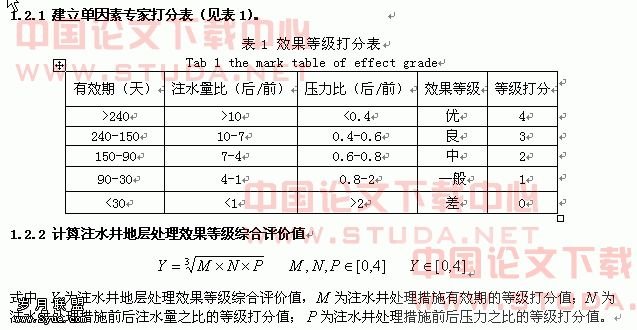
牙龈卟啉单胞菌菌毛蛋白fimA基因在大肠杆菌中的融合表达和纯化(一)
关键词:牙龈卟啉单胞菌 菌毛 大肠杆菌表达系统 融合蛋白 固定化金属螯合亲和层析
论文摘要:研究背景:慢性牙周炎在我国有很高的发病率,严重影响国民健康水平。慢性牙周炎不仅是导致成人牙齿功能丧失的主要原因之一,而且还可能是某些系统性疾病的危险因素。慢性牙周炎是一种细菌感染性疾病,牙龈卟啉单胞菌(Porphyromonas gingivalis, Pg)是其主要可疑致病菌。菌毛(fimbriae)是Pg的重要致病因子,可介导Pg附着于口腔内各种组织细胞的表面,以有利于Pg在体内进一步的粘附和侵袭;可引发炎症反应和免疫反应。并且菌毛具有良好的免疫原性,可诱导机体的保护性免疫应答。目前,慢性牙周炎的效果还不理想,因此探索预防慢性牙周炎的有效途径具有重要意义。
研究目的:本研究拟在大肠杆菌中表达FimA蛋白并进行蛋白纯化。为后续实验制备抗FimA蛋白的多克隆抗体提供实验基础。
研究方法:1. 以大肠杆菌BL21(DE3)pLysS为宿主菌,用IPTG诱导fimA表达,通过SDS-PAGE和Western blot来验证蛋白的表达结果,并进行蛋白表达形式分析。2. 大量诱导表达融合蛋白,用Co2+柱亲和层析纯化表达产物,通过SDS-PAGE和Western blot来验证纯化产物,纯化产物经透析复性后用BCA法蛋白定量试剂盒作蛋白含量测定。
研究结果:1. 经IPTG诱导表达后,工程菌在SDS-PAGE上出现一条新蛋白带,分子量与预期大小基本一致(约41kDa),IPTG浓度及诱导时间对融合蛋白表达量影响较大:当IPTG浓度为2 mmol/L,诱导时间为3 h时蛋白表达量最大;当IPTG浓度为1 mmol/L,诱导时间为1 h时蛋白表达量最小。6×His-FimA表达产物经SDS-PAGE后,转移至硝酸纤维素膜,X线片感光,在X线片上相应位置呈现阳性结果,可见一明显蛋白条带,而空质粒pET-15b对应位置未见特异条带。蛋白表达形式分析结果表明表达的融合蛋白位于包涵体中。2. 表达产物经Co2+柱亲和层析, SDS-PAGE上出现一致的单一条带,其分子量大小与预期相符(约41kDa)。6×His-FimA纯化产物经SDS-PAGE后,转移至硝酸纤维素膜,X线片感光,在X线片上相应位置呈现阳性结果,可见一明显蛋白条带,条带位置与BL21(DE3)pLysS全菌诱导表达后相应蛋白位置一致。经BCA法蛋白浓度定量试剂盒对纯化后的蛋白质进行定量分析,出纯化后的FimA蛋白浓度为0.96 mg/ml。
主要结论:用本课题组前期构建的fimA基因的原核表达质粒pET-15b-fimA,在大肠杆菌BL21(DE3)pLysS中诱导表达后,fimA基因能够得到正确表达。表达产物经Co2+柱亲和层析,可以得到带6×His标签的FimA融合蛋白。
1 绪论
慢性牙周炎是导致成人牙齿功能丧失的主要原因之一,在我国有很高的发病率,严重影响国民健康水平。牙周炎造成的牙周组织的破坏是持续性的,一旦发生,目前的治疗手段还不能使牙周组织达到完全的恢复。牙周炎还可能是某些系统性疾病的危险因素。随着我国的、人民生活水平的提高和人群寿命的延长,对牙周健康状况的关注日益提高。因此,探索预防慢性牙周炎的有效途径对于提高国民健康水平具有重要意义。
疫苗在人和家畜疾病防治方面具有极大的作用,是一种有效的防治疾病的手段。从减毒活疫苗、死疫苗、亚单位疫苗、重组疫苗到DNA疫苗,由于技术不断改进,使得疫苗有了广泛的应用,被成功的用于许多细菌或病毒感染的防治,因此以疫苗来防治牙周炎也已成为一个重要思路。
慢性牙周炎是一种细菌感染性疾病,牙龈卟啉单胞菌(Porphyromonas gingivalis, Pg)是其主要可疑致病菌[1]。菌毛是Pg表面主要毒力因子之一,菌毛蛋白(fimbrillin,FimA)是其主要亚单位,能够介导Pg对宿主组织的粘附与入侵,以及与口内其他细菌的粘附共聚[1-3],还能刺激炎性因子的产生[4]。多菌毛Pg野生型菌株可引起定菌大鼠牙槽骨吸收,而无菌毛的突变菌株则不会造成牙槽骨的破坏。也有实验发现,用FimA免疫大鼠可减轻由Pg引起的牙槽骨破坏[5],将抗FimA的单克隆抗体用于口腔被动免疫,可以抑制该菌在口腔的定植[6]。因此,可以将FimA作为防治牙周炎疫苗抗原。
Pg菌毛的单体是FimA,由单拷贝fimA基因编码。fimA基因全长1290 bp,开放读框包括1044 bp,编码347个氨基酸。翻译后产物菌毛蛋白的功能域(如刺激T细胞和B细胞的位点、刺激细胞因子产生的位点等)位于氨基酸序列的31~331aa不等,各个位点之间可相互交叉或覆盖。近年来由于分子生物学和免疫学的发展,fimA基因已被克隆和测序,对蛋白质分子中的各个功能区、抗原表位已有了更深入的了解,为研制疫苗提供了可靠的依据。
根据国内外研究进展,在前期已构建fimA原核表达质粒的基础上,本研究拟在大肠杆菌BL21(DE3)pLysS中表达FimA融合蛋白,并通过金属螯合亲和层析技术进行纯化,为后续实验制备抗FimA蛋白的多克隆抗体、研发用于人类的、可有效防治牙周炎的DNA疫苗提供实验基础。
2 回顾
牙周炎是口腔疾病中的常见病和多发病,在我国有很高的发病率[7]。牙周炎累及牙齿数目多,预后差,是造成牙齿缺失的主要原因。随着我国进入老龄化社会,牙周炎的预防将成为突出的保健问题。世界卫生组织已将牙周组织健康列为健康人的十项标准之一[7]。探索预防和治疗这种严重危害人类口腔健康的疾病的方法,对于改善我国人民的口腔健康水平,提高人们的生活质量有着重要意义。
大量的实验研究、流行病学资料和临床观察表明[7],牙周炎是菌斑微生物引起的感染性疾病。菌斑微生物是引发牙周炎的始动因子,是造成牙周组织破坏的必须因素。牙周菌斑中绝大多数细菌为口腔固有菌丛,对宿主无不良影响,仅少数细菌与牙周炎的发生、发展密切相关。其中牙龈卟啉单胞菌(Porphyromonas gingivalis, Pg)是目前获得公认的一种牙周致病菌,它是牙周病,尤其是成人慢性牙周炎病变区或活动部位最主要的优势病原菌,而健康龈沟内很少[7, 8]。目前牙龈卟啉单胞菌也是牙周微生物学领域重点研究的厌氧菌之一。除口腔疾病外,在全身系统性疾病的研究中,血清学、动物模型、细胞培养的研究证实[9-11] Pg感染与心脑血管疾病的发生有关,而且有学者报道[12]Pg的感染与低体重婴儿的分娩也有关。
Pg含有大量毒性因子,如蛋白酶、菌毛、脂多糖、血凝素等。其中菌毛在牙周致病作用中占据重要地位,而且与Pg在口腔的定植有关,为Pg的优势抗原之一。另外,因其具有广泛的生物学活性而成为牙龈卟啉单胞菌研究的一个热点。
菌毛(pili,fimbriae)是位于革兰氏阴性菌Pg菌体表面的一种弯曲的、单股的丝状物,长0.3~1.0 μm,直径为3.5~5.0 nm,遍布细菌表面,多者每菌可有数百根,由菌体表面伸向细胞外。其化学组分是一种蛋白质,与细菌的运动无关。
2.1 菌毛的致病机制 2.1.1 介导Pg附着于口腔
Pg附着于宿主组织表面是其定植于口腔的关键,也是其致病的先决条件。Pg可选择性的直接附着于口腔内特定部位组织的表面,或识别已经附着在组织表面的细菌,然后间接的附着于组织表面。
1)菌毛可介导Pg附着于口腔内各种组织细胞的表面
菌毛可介导Pg黏附于龈沟液中的成分(如人血红蛋白和纤维蛋白原);唾液中的重要蛋白质成分(如富脯蛋白PRP、富脯糖蛋白PRG、富酪蛋白PRT);乳铁转运蛋白,细胞外基质蛋白(ECM)(如玻连蛋白和纤维连接蛋白)。人细胞外基质蛋白通过与FimA受体配体的结合在细胞外信号转导中起重要作用。菌毛对基质蛋白有很强的亲和力,而且明显抑制玻连蛋白/纤维连接蛋白与其受体αβ3和配体α5β(在仓鼠卵巢CHO细胞株中过度表达)的相互结合。在牙周组织中,菌毛可能通过细胞外基质蛋白受体/配体途径阻断细胞外信号转导。
菌毛还可介导Pg黏附于牙龈上皮细胞、牙周袋上皮细胞、人口腔上皮细胞、人脐静脉内皮细胞、成纤维细胞和巨噬细胞,附着并凝集人或羊的红细胞等。Umemoto[13]构建了无菌毛的Pg突变株,发现其对人口腔上皮癌细胞的黏附性和侵袭性均降低,接种小鼠后引起牙槽骨丧失的量也减少。其他学者构建了不表达菌毛的Pg缺陷株,发现它们黏附和侵袭人牙龈成纤维细胞[14]、上皮细胞[15]、内皮细胞[16]和树突状细胞[17]的能力也降低,甚至不能黏附。这些研究结果说明菌毛在Pg黏附于口腔上皮细胞的过程中起重要作用。
此外,研究发现Pg可黏附于唾液覆盖的羟基磷灰石(hydroxyapatite coated with saliva,sHAP),这种黏附活动常被作为研究Pg与口腔内唾液覆盖的各种组织细胞黏附活动的模型。Lee[18]等的研究发现,Pg与羟基磷灰石之间的这种黏附活动需要菌毛参与,而且抗菌毛的抗体能完全抑制这种黏附作用。学者们[14, 16]通过同源重组技术灭活fimA基因后,发现突变株与sHAP的黏附能力降低。这些研究结果提示FimA菌毛蛋白在Pg黏附到唾液覆盖的口腔内各种组织表面的过程中起重要作用。
2)在菌斑形成的早期,菌毛可介导Pg黏附于附着在获得性膜表面的细菌,间接的附着于组织表面
细菌之间的相互黏附和共聚有助于早期生物膜的形成。链球菌是最先定植于牙齿表面的主要细菌,Pg通过菌毛与链球菌细胞表面的甘油醛-3-磷酸脱氢酶(GAPDH)高亲合力、高特异性的结合而与链球菌发生共聚,这种相互作用在Pg定植于牙周袋的过程中可能起重要作用。此外菌毛还参与Pg与放线菌、福赛氏类杆菌之间的黏附过程。
3)有关黏附机制的研究
现在已经明确Pg黏附于口腔的过程为一种特异性识别过程,菌毛可能为特异性配体,与宿主细胞膜上的特异性受体相互作用[7]。部分Pg菌毛可识别的黏附受体现已明确,如βintegrins[7,19]、上皮细胞的细胞角蛋白14[20]、巨噬细胞(MCs)上的TLR2和CD14[7]。菌毛通过上皮细胞的βintegrins促进Pg与牙龈上皮细胞的黏附,抗βintegrins的抗体能抑制Pg的黏附和侵袭[19]。Pg菌毛通过单核细胞上的TLR2、CD14和CD11a/CD18,诱导外周血单核细胞IL-6 mRNA的产生、细胞因子的分泌、p38促有丝分裂蛋白激酶磷酸化和NF-κB的活化。小鼠腹膜巨噬细胞的实验研究表明,β2 integrins(CD11/CD18)是小鼠腹膜巨噬细胞与Pg菌毛黏附的细胞受体;而且β链(CD18)在信号转导中起关键作用。
综上所述,菌毛可介导Pg黏附于龈沟液中的成分(如人血红蛋白和纤维蛋白原);人唾液成分(如富脯蛋白PRP、富脯糖蛋白PRG);乳铁转运蛋白、细胞外基质蛋白;宿主细胞(如牙龈上皮细胞、牙周袋上皮细胞、成纤维细胞、人脐静脉内皮细胞,巨噬细胞等);口腔内的细菌(如链球菌、放线菌、福赛氏类杆菌)。借助于菌毛黏附于这些物质,Pg可在口腔内进一步定植、侵袭、诱导炎症反应的发生。
2.1.2 引发炎症反应和免疫反应
Pg附着于口腔内组织细胞后,其抗原成分和毒性产物等可引发白细胞的趋化、吞噬等炎症过程,造成表面组织的损伤——其中Pg菌毛能与脂多糖一起激活宿主的防御机制、诱导多种炎性细胞因子的产生;此外细菌及其产物还通过上皮细胞或者细胞间质进入表层下组织,在组织内繁殖,甚至扩散至全身。
1)Pg菌毛的白细胞趋化作用
牙周炎再现了一种重要的中性粒细胞介导的破坏宿主组织细胞的模型。牙周炎的优势病原菌Pg产生的毒力因子主要就是用于调节中性粒细胞的反应。其中Pg菌毛能诱导多种可趋化白细胞至炎症部位的细胞因子的分泌。
Pg菌毛可诱导内皮细胞表达趋化因子IL-8(Interleukin-8)和单核细胞趋化蛋白-1(monocyte chemoattractant protein 1,MCP-1):感染了野生型Pg的人脐静脉血管内皮细胞持续低剂量的表达IL-8和MCP-1,而Pg的fimA基因突变株则不能诱导IL-8和MCP-1产生。同时,抗菌毛的特异性抗体也能阻断上述因子的产生。这些提示IL-8和MCP-1的产生是由菌毛特异性引起的。
IL-8和MCP-1都是诱导白细胞到免疫反应部位的有效的趋化因子。MCP-1又称单核细胞趋化激活因子(monocyte chemoattractant activating factor, MCAF),它作为趋化因子超家族的一个主要成员,可以由机体多种细胞合成和分泌(如人牙龈上皮细胞),是重要的炎性细胞因子,在机体对入侵的病原微生物的炎症反应和免疫反应中,起重要调节作用。MCP-1的主要生理作用是特异性的趋化中性粒细胞和巨噬细胞向炎症部位聚集, 同时还有激活巨噬细胞的功能。而且炎症部位的细胞因子如IL-1、TNF-α等可以刺激机体的免疫细胞及其他细胞表达MCP-1,该过程中所产生的MCP-1能进一步特异性的趋化巨噬细胞和单核细胞向病损部位聚集。中性粒细胞和巨噬细胞向炎症部位聚集,是炎症反应中的一个重要过程。巨噬细胞是参与牙槽骨代谢的重要的免疫细胞,被激活的巨噬细胞能产生大量的骨吸收性细胞因子。也有学者认为巨噬细胞是破骨细胞的前体细胞,在破骨细胞分化因子的存在下,体外培养的巨噬细胞可以向破骨细胞分化。而牙槽骨的吸收是牙周病的一个重要病理特点,是病变进程、发展和愈后的一个重要指标。这些提示Pg菌毛能通过免疫细胞及其他细胞产生的MCP-1间接的趋化巨噬细胞向炎症部位聚集,增加破骨细胞的数量,促进破骨细胞的分化和成熟,进而促进牙槽骨的吸收。
Pg菌毛可诱导内皮细胞表达粘附分子ICAM-1、VCAM-1和选择素(selectin):Pg菌毛诱导人脐静脉内皮细胞表达细胞内黏附分子-1(intercellular adhesion molecule-1,ICAM-1)、血管细胞黏附分子-1(vascular cell adhesion molecule-1,VCAM-1)以及P-selectin/E-selectin。而且加入按照人工合成的菌毛氮末端氨基酸序列多肽能上调上述分子的表达,而Pg 的fimA基因突变株或含有抗Pg菌毛蛋白抗体的血清与人脐静脉内皮细胞共培养时,不能诱导上述分子的表达。
内皮细胞通过上述分子selectin,ICAM-1和VCAM-1可诱导和趋化血液循环中的白细胞黏附至内皮细胞。其中选择素是血管粘附分子大家族中的一大类成员,根据表达部位可分为三类[21]:表达于活化的内皮细胞表面的E-selectin;表达于白细胞表面的L-selectin;表达于活化的血小板和内皮细胞表面的P-selectin。在感染以及其他炎性反应发生过程中,selectin通过与其相应配体结合介导白细胞(中性粒细胞、T-和B-淋巴细胞以及单核细胞等)与血管壁(特别是毛细血管后静脉)接触,并使白细胞在血管壁上缓慢滚动,从而启动一系列反应,最终导致白细胞在炎性反应区域集中。ICAM-1也可促进白细胞黏附、移动和趋化至炎症部位。血液循环中的单核细胞和白细胞黏附和趋化至内皮细胞,然后穿过内皮细胞在局部聚集是炎症反应的重要过程。Pg菌毛通过诱导内皮细胞所表达的selectin、VCAM-1和ICAM-1,趋化单核细胞和白细胞至炎症反应的局部,可能在牙周病中起重要作用。
2)Pg菌毛诱导多种炎性细胞因子的产生
(1)Pg菌毛诱导外周血单核细胞产生炎性细胞因子IL-1β、IL-6、TNF-α和化学趋化因子IL-8,诱导p38促有丝分裂蛋白激酶磷酸化,刺激单核细胞诱导的细胞核因子-κB(nuclear factor kappa B,NF-κB)p50和p65亚单位的活化(通过TLR信号转导途径),从而诱导高滴度的NF-κB依赖性细胞因子的释放。NF-κB是细胞中一个重要的转录调节因子,是Rel家族的成员,几乎存在于所有细胞中,在免疫反应、应激反应、细胞凋亡及病毒复制的调节中起主导作用,可在炎症部位高度表达,提示其在免疫反应和炎症反应中起着关键作用。受NF-κB调节的炎性细胞因子有:肿瘤坏死因子(tumor necrosis factor,TNF-α和TNF-β);粘附分子(ICAM-1,VCAM,E-selectin);白介素(IL-1,IL-2,IL-6,IL-8,IL-12);集落刺激因子(CSF)(粒细胞-CSF,粒细胞和单细胞-CSF);β-干扰素(INF-β)等。因此,NF-κB是多种促炎症基因高度转录的必须因子。同时,由NF-κB调节的产物,如TNF-α和IL-1β又能激活NF-κB,这就意味着存在一个能放大且延续炎症反应的复杂的调节环路。
(2)Pg菌毛还能通过TLR2信号途径诱导小鼠腹膜巨噬细胞产生RANTES、INF-γ、IL-17、VCAM-1、血管内皮细胞生长因子,诱导MCP-1 mRNA的强表达。CD18可能在相关的信号转导机制中起重要作用。Pg菌毛可诱导巨噬细胞样细胞株U937表达IL-1β,IL-8,IL-12和TNF-α。fimA基因正常表达的Pg菌株能诱导单核细胞来源的树突状细胞表达炎性细胞因子TNF-α、IL-6,免疫调节细胞因子IL-10和趋化因子IL-8,而fimA基因的突变菌株Pg DPG3就不能诱导上述细胞因子的表达。而且用菌毛蛋白刺激单核细胞来源的树突状细胞,能在自体混合淋巴细胞反应(MLR)和自体的CD4+ T细胞中诱导以IFN-γ为主要细胞因子的Th1-型免疫反应。
关于菌毛诱导各种炎性细胞因子的产生的机制,Hajishengallis[22]的研究表明:体内免疫系统的Toll-like receptors(TLRs)和其他模式识别受体(pattern-recognition receptors,PRRs)组成了一种功能性受体复合物,识别并对病原菌相关模式分子(pathogen associated molecular patterns,PAMPs)起反应。在这种相互作用中,菌毛作为一种病原菌相关模式分子与宿主细胞的模式识别受体复合物相结合。CD14和CD11b/CD18是一种募集性受体,TLRs则是一种信号转导受体。TLR2和TLR4与介导菌毛活化细胞有关,其他的模式识别受体如CD14和CD11b/CD18与介导细胞对菌毛的识别有关。菌毛通过激活TLR信号转导途径,诱导单核细胞产生炎性细胞因子IL-1β、IL-6、TNF-α和化学趋化因子IL-8,并诱导抗原呈递细胞中协同刺激性分子CD40、CD80和CD86表达的上调。此研究结果也提示菌毛对宿主免疫系统有潜在的“危害”。
3)Pg菌毛诱导多种与调节骨代谢有关的细胞因子的产生,改变牙槽骨的代谢,诱导骨的吸收
Pg菌毛所诱导产生的细胞因子如IL-1、TNF-α是骨重建中重要的局部调节因子,在牙槽骨的吸收破坏中起重要作用,可促进结缔组织基质的降解,刺激骨的吸收,与牙周炎密切相关[1];IL-1、IL-8、TNF-α等细胞因子还可通过自分泌和旁分泌途径,刺激更多的IL-1、IL-8、TNF-α的产生,使炎症加重和扩大,引起组织的进一步破坏。提纯的菌毛蛋白还能浓度依赖性的诱导肝细胞生长因子HGF/SF的产生。HGF/SF,也名为趋化因子SF,由间充质细胞产生,主要作用于上皮细胞,与刺激破骨细胞的活化有关。
Evans[23]研究发现表达菌毛的Pg能诱导无菌鼠牙槽骨丧失,而不产生菌毛的Pg诱导无菌鼠牙槽骨丧失的能力显著降低,而且用提纯的菌毛蛋白免疫无菌鼠可预防Pg所导致的牙周组织的破坏。这也证实了菌毛与牙槽骨的吸收密切相关。
4)Pg菌毛抑制单核细胞和巨噬细胞的凋亡
单核细胞和巨噬细胞的凋亡可能与慢性炎症性疾病密切相关。在缺乏生长因子的培养液中,Pg菌毛蛋白可抑制人单核细胞THP-1的凋亡。这种抑制作用能被抗菌毛蛋白的抗体所完全抑制。菌毛可激活细胞外信号传导激酶(signal-regulated kinase,ERK),刺激细胞内依赖细胞周期的蛋白激酶抑制剂p21的表达,从而阻断单核细胞和巨噬细胞的凋亡,提示菌毛可阻断单核细胞和巨噬细胞的凋亡,是慢性炎症性疾病牙周病的一种重要的调节分子。
5)Pg菌毛诱导免疫反应
慢性牙周炎与牙龈卟啉单胞菌感染不成熟树突状细胞(dendritic cells,DCs)、诱导真皮下DCs和基底膜中成熟的DCs数量的增加有关。Jotwani[24]的研究证实fimA基因正常表达的菌株Pg381与fimA基因的突变菌株PgDPG3相比,能更高效进入单核细胞来源的树突状细胞(monocyte-derived dendritic cells,MDDCs)中,诱导DCs的成熟。Pg381感染MDDCs后,能诱导高水平的自体混合淋巴细胞反应,诱导Th1-型免疫反应。用菌毛蛋白刺激MDDCs,也能诱导DCs成熟,而且成熟的MDDCs还能诱导自体同源性CD4+T细胞的增殖,γ-干扰素(gamma interferon,IFN-γ)的释放。这些结果提示Pg菌毛可能在诱导MDDCs吞噬Pg和诱导Th1-型免疫反应中起重要作用。
Amano[25]报导在牙周炎病人体内能检测到高滴度的抗菌毛的特异性IgG和IgA抗体。Condorelli[26]报导在牙周炎病人71.7%活动性位点和58.7%非活动性位点的龈沟液(gingival crevicular fluid ,GCF)中能检测到抗Pg菌毛的特异性IgA抗体,而在健康对照组的所有位点的GCF中均不能检测到抗菌毛的特异性IgA抗体。这些流行病学研究的结果表明Pg菌毛具有良好的免疫原性,能在体内诱发免疫反应。
Pg菌毛所诱导的免疫反应具有保护作用:Evans[23]等用提纯的菌毛蛋白和一种人工合成的20个氨基酸的菌毛多肽免疫无菌鼠后,鼠血清中抗菌毛的特异性抗体滴度较用全菌免疫后鼠血清中的抗体滴度高3~4倍。当给无菌鼠口腔接种Pg后,菌毛免疫鼠的牙周组织未受到破坏。Yanagita[27]以菌毛蛋白鼻腔黏膜免疫小鼠(霍乱毒素CT为免疫佐剂),能在黏膜效应组织(包括鼻腔通道,颌下腺)的CD4+T细胞诱导Th1-/Th2-型免疫反应。而且颌下腺产生的抗原特异性的IgA多克隆抗体可抑制Pg黏附于上皮细胞,减少上皮细胞细胞因子的产生。提示菌毛是一种有潜力的研制牙周炎疫苗的候选免疫原。
6)Pg菌毛诱导泡沫细胞的形成
有学者报导Pg的感染与动脉粥样硬化[28]的发生有关。动脉粥样硬化是一种由血管壁开始的慢性炎症性反应,其中泡沫细胞的形成是其重要特点。Giacona[28]研究证实人体巨噬细胞在感染野生型Pg后,形成泡沫细胞的量明显增加,但是感染fimA基因的突变菌株Pg DPG3后没有明显的变化,提示菌毛是Pg诱导泡沫细胞形成的必须因素,Pg菌毛可能与动脉粥样硬化的发生有关。
2.2 有关fimA基因表达调控的研究进展
Pg fimA基因的表达途径有以下三种[29](按照表达和装配系统分类):陪伴/引导分子途径系统、第二分泌系统、核化依赖聚合系统。fimA基因表达的初始产物具有非常长的前序列。Pg蛋白酶参与fimA基因的翻译后处理、转运和装配[29]。fimA基因的表达还受到以下因素的影响。
1)局部理化环境对Pg fimA基因表达的影响
研究表明[30],Pg fimA基因的表达及菌毛依赖性表型的活性均受到温度、离子浓度等环境条件的影响。
龈下区的温度并不恒定,常随牙齿部位及炎症程度而变[31],健康龈下区温度一般在34℃~37℃,而炎性牙周袋内温度 可达39℃。Xie等[32]通过fimA启动子-lacZ受体基因融合研究环境因素对Pg fimA基因表达的影响时,发现当龈下区温度由34℃升至39℃时,Pg fimA基因表达可减少至1/10。Murakami等[33, 34]的研究同样证实温度升高时,基因fimA的表达水平降低。Amano等[35]报导温度从37℃提高到39℃时,Pg对唾液成分和链球菌的黏附能力降低,Pg在牙周炎病人的血清中的抗原性发生改变。温度影响DNA的超螺旋结构,改变组蛋白与DNA结合的活性[36],从而降低基因转录的速度[37]。Pg根据温度的变化来调整fimA基因表达的水平,可能是在机体感染Pg早期,fimA基因表达水平较高,有利于Pg黏附及侵入牙周组织;随着炎症程度加重、牙周袋形成和局部温度升高,菌毛的产生受到遏制,从而使菌毛的某些功能特性发生改变,而有利于Pg的生存。
基因fimA的表达还在转录水平受氯化高铁血红素浓度的调节[38]。铁在Pg的生长繁殖和毒力中起关键作用,Pg以血红素的形式吸收铁[39]。McKee[40]等发现,Pg在氯化高铁血红素过量时,毒力增强。在氯化高铁血红素不足时,Pg生长速度降低,Pg菌体表面菌毛数量减少[40],血凝素基因hagB和hagC的mRNA表达水平降低[41],但是,致病因子如溶血素和胰蛋白酶样蛋白酶等的数量及其致病毒力均明显增加[42, 43]。为进一步阐明氯化高铁血红素在调节fimA基因表达中的作用,Xie等[38]研究了fimA基因的转录活性,结果显示在缺乏氯化高铁血红素的情况下,fimA启动子活性降低50%,表明氯化高铁血红素可以对Pg fimA基因表达起正调控作用。但是这种调控作用不如温度变化对其影响的程度明显。虽然在氯化高铁血红素缺乏时,Pg的生长速度降低,但此时fimA启动子活性降低与Pg生长速度的降低并没有直接的联系[38],fimA启动子的活性并不依赖于Pg的生长阶段。氯化高铁血红素调节Pg fimA基因表达的具体分子机制仍不清楚,许多受离子调控的基因在其启动子区均存在“离子盒”,而在fimA启动子区并没有与此具有同源性的区域结构[44]。推测可能是由于Pg多种致病因子基因的表达共同受到氯化高铁血红素的调节所致。
影响Pg fimA基因表达的局部理化环境还包括血清、唾液、渗透压、Ca2+浓度以及pH值等。
关于Pg如何感受到环境的变化,并把这种信息传递给细胞的机理并不完全清楚。但是研究发现信号转导系统的两种成分FimS-FimR与Pg fimA基因的表达有关[45]。FimS是一种组氨酸蛋白激酶基因的等位基因,FimR是反应调节基因的等位基因[45]。FimS 和FimR的分裂会导致菌毛形成量的明显降低。fimA基因的表达可能受到FimR反应调节器的正调控[46]。FimR调控包括fimA基因位点周围的5个成串的基因——fimA cluster在内的多个基因的表达。染色体免疫沉淀反应和电泳分析表明,菌毛蛋白黏附到fimA cluster中的第一个基因的启动子区域。突变菌株的基因表达分析表明,fimA基因转录过程包括多个步骤,FimR基因上调fimA cluster中的第一个基因的表达,而此基因编码一个在fimA基因的表达中起关键作用的调控蛋白。
2)其他口腔微生物对Pg fimA基因表达的调控
牙菌斑是一种附着了各种细菌的生物膜,这些菌斑微生物之间可以通过细胞间信号转导机制互相影响。Pg通过与获得性薄膜中的唾液分子[25]或者先前定殖的细菌如口腔链球菌[1]相接触而定殖于牙菌斑生物膜中,然后与牙菌斑生物膜中的其他微生物共生。但是,Pg不能聚集于链球菌突变株或者S.cristatus这一底层的上面[47]。针对这一现象的进一步研究揭示链球菌S.cristatus CC5A能明显降低Pg的fimA基因的表达水平,其浓度与fimA基因表达水平呈负相关,浓度升高时甚至可使fimA启动子活性下降1/2[48]。但是,在实验中尚未发现菌斑中的其他细菌,如纤细链球菌G9B和M5、血链球菌10556、变形链球菌KPSK2、内氏放线菌NC-3、齿垢密螺旋体GM-1以及具核梭杆菌10953等对fimA基因的表达具有这种调控作用[49]。
目前的研究结果认为,S.cristatus CC5A与Pg之间的这种信号转导开始于Pg受体对CC5A信号的识别[47]。信号分子是链球菌S.cristatus细胞膜表面的一种分子量为59kDa的CC5A蛋白,与其他革兰氏阳性菌分泌的短信号肽有明显区别[49]。菌毛自身并非受体,fimA基因突变的Pg株与CC5A蛋白的结合与野生型Pg菌株与CC5A蛋白的结合没有区别。这些结果表明,早期共生菌斑和后期致病性菌斑中的许多细菌并不影响fimA启动子转录的活性,不影响Pg菌毛的产生,因而能够与Pg相互共存。但是,S.cristatus CC5A能特异性地使Pg fimA表达水平降低,从而影响菌毛的产生,阻止Pg在菌斑内的进一步的繁殖。
3)Pg自身产物对fimA基因表达的调控
目前,定点诱变试验表明[50],在fimA基因上游区域存在一个σ70-识别的RNA聚合酶结合位点,研究证明,调节蛋白能够与此位点特异性的结合,从而影响RNA聚合酶的功能。Xie等[48]发现有三种蛋白可结合于fimA基因,分别是菌毛蛋白、赖氨酸蛋白酶(Kgp)以及精氨酸蛋白酶(Rgp)的翻译后处理片段。
将外源fimA启动子-LacZ受体插入携带fimA突变基因的Pg菌株内,结果发现插入的外源性fimA启动子不能活化,fimA mRNA表达水平低;但若仅使fimA结构基因上游区域产生突变,则不影响启动子的活性,fimA mRNA的表达水平与野生型菌株相同[48]。提示fimA基因在表达过程中,表达产物可作为调节蛋白与自身启动子上游区的RNA聚合酶结合位点结合,从而正反馈性调节Pg fimA基因的表达。
Pg的半胱氨酸蛋白酶(Rgp和Kgp)也参与调节fimA基因的表达。有研究[51]报道当rgp表达水平较低时,Pg表面菌毛数量减少。rgpA和kgp基因失活的Pg菌株YPP1和YPP2与野生型Pg相比,fimA mRNA表达水平明显降低[52]。Pg 381的rgp A基因突变的变异株不表达菌毛,rgpB基因变异菌株表达的菌毛水平较野生型菌株低[48]。Tokuda[53]等也证明rgpA单基因突变菌株的fimA mRNA表达水平下降,表达的菌毛蛋白很少,通过Western印迹分析不能检出菌毛蛋白,其表面的菌毛通过电镜也无法观测到。菌株Pg 33277 的rgpA和rgpB双基因缺陷变异菌株则不表达菌毛[48]。这些研究结果均证明蛋白酶可在转录水平直接影响菌毛蛋白的产生。此外,在菌毛蛋白翻译后修饰加工的过程中,Pg蛋白酶还参与到对菌毛蛋白N-末端氨基酸的修饰加工。
这些资料均表明包括菌毛蛋白、Rgp和Kgp蛋白酶在内的几种Pg来源的蛋白都是fimA基因表达调控系统的组成部分,它们能够与fimA基因的上游区域结合,从而影响fimA基因的mRNA表达水平。
综上所述,影响Pg fimA基因表达的因素有:局部理化环境,包括温度、氯化高铁血红素的浓度、血清、唾液、渗透压、Ca2+浓度以及pH值等;牙菌斑中的细菌如S.cristatus CC5A;Pg自身产物,如菌毛蛋白、Rgp和Kgp蛋白酶等。如能对fimA基因的表达过程详细研究,在fimA基因转录的过程中加以某种干预,使Pg菌毛蛋白的转录、翻译水平降低,或者使fimA基因翻译后的修饰加工过程受到干扰,使菌毛所介导的Pg的黏附、侵入降低,病理性作用减少,就有可能降低Pg相关性牙周炎的发病率和严重性,这也是未来的一个研究方向。
2.3 有关fimA基因分子克隆的研究进展Dickinson等[54]1988年首次克隆并测序了Pg381 fimA基因。Fujiwara等[55]1993年克隆并测序了9种Pg菌株的fimA基因,结果揭示这9种Pg菌株的fimA基因覆盖1044~1083 bp,所编码的多肽分子量为37,527~38,239,菌株之间有一部分相同的序列,同时具有大量的不同序列。Fujiwara[55]首次按照fimA基因核苷酸序列的不同,将Pg分为4种基因型。
Sharma等[56]1993年首次用表达载体pET-lld,大肠杆菌BL21表达了Pg 2561的部分菌毛多肽(氨基酸10~337)。Washington等[57]1993年用表达载体pET-lld,大肠杆菌BL21表达了Pg 381 fimA的一部分片段(1 kb)(fimA基因全长为1044bp)。
Sharma等[58]1996年首次构建了表达部分菌毛多肽的重组链球菌——一种活载体疫苗。以pUC13Bg12.1为模板,将编码Pg 2561 FimA蛋白部分肽段(N-末端55~145[90个aa]和C-末端233~322残基[89个aa])的基因,PCR扩增后,定向插入到链球菌(Streptococcus gordonii)M6基因(emm6.1)的Kpn I-Hind III位点,获得融合表达质粒pSMB55,然后转染于口腔链球菌(S. gordonii GP251)中,制备为一种以细菌为载体的基因工程减毒活疫苗。在链球菌M6蛋白(氨基酸1~122和302~441)的锚定区,表达菌毛多肽(氨基酸55~145和233~322),形成一种融合蛋白。此链球菌所表达的菌毛多肽可竞争性的抑制Pg结合于唾液覆盖的羟基磷灰石上。而且将此疫苗菌株口腔内免疫无菌鼠后,可诱导血清中特异性IgA、IgG抗体和唾液中特异性IgA抗体的产生,并能防止Pg所导致的牙槽骨的吸收[59]。Sharma等[60]1999年进一步在链球菌Streptococcus gordonii表面,表达FimA蛋白的C-末端多肽(226~246),但是实验证实这种包含游离半胱氨酸残基的多肽在链球菌的表面表达很弱。
Kawabata等[61]1999年以克隆质粒pSM36为模板克隆了fimA基因,以真核表达质粒pcDNA3首次构建了fimA核酸疫苗pcDNA3/fimA。体外转染NIH3T3真核细胞后,可检测到菌毛蛋白的表达,说明了在真核细胞中表达FimA蛋白的可行性。定向唾液腺(TSG)免疫BALB/c小鼠后,成功的诱导了体液免疫和细胞免疫,在唾液和血清中能检测到特异性抗体。免疫后的小鼠,血清中抗FimA特异性IgG抗体主要的亚类是IgG2a,唾液腺单核细胞Th2-型细胞因子特异性mRNA增加,脾中产生抗原特异性的细胞毒性T淋巴细胞。
Shin等[62]2005年首次报道在植物中表达菌毛多肽。Shin等[62]克隆FimA蛋白的C-末端氨基酸残基266~337的编码基因,然后插入到植物的表达载体中编码CTB(霍乱毒素B亚单位)的基因片段的下游,然后此嵌合性载体ctb-fimA被转染到马铃薯(Solanum tuberosum)细胞中表达蛋白。通过ELISA对CTB-FimA融合蛋白的定量分析表明,此蛋白占全部可溶性蛋白的0.33%,表达量较低,尚需要进一步改进。
国内刘鲁川[63]1994年首先以pUC13Bg12.1质粒为模板,PCR扩增fimA基因部分片段(504~1045 bp,总扩增长度为542 bp)。
郭红梅[64]2007年成功的构建了FimA蛋白与IL-15真核共表达质粒,以其作为DNA疫苗经滴鼻免疫Wistar大鼠,能够激发 机体产生特异性的系统免疫应答,又能激发粘膜免疫应答。疫苗所表达的IL-15可以作为辅助因子增强sIgA应答,对Pg引起的实验性牙周炎提供有效的保护,为解决增强sIgA应答来对牙周组织提供保护的难题提供思路。
2.4 有关大肠杆菌表达系统
2.4.1 大肠杆菌表达系统
大肠杆菌表达系统是目前最常用的外源蛋白表达系统[65] 。大肠杆菌系统由于其遗传学、生物化学和分子生物学方面已充分被人们了解,而且有大量可供选择的克隆载体与表达载体,已经成为表达许多异源蛋白质的首选表达系统[66,71]。大肠杆菌遗传图谱明确,容易培养且费用低,对许多蛋白质有很强的耐受能力,能高水平的表达这些蛋白质。但是,在实际工作中,常常需要使外源基因得到最佳的表达,以满足人们各种研究需要。此外,许多外源基因在大肠杆菌胞内表达时,往往不能自发折叠卷曲生成有一定空间结构的特定功能的蛋白质,而是以一种不溶性的沉淀即包涵体的形式存在于细胞内[67 ,68 ] 。包涵体的形成在某种程度上限制了大肠杆菌表达系统的应用。由于处于包涵体中的重组蛋白没有生物活性,为使重组蛋白具有生物活性,必须将包涵体复性,而包涵体的变性、复性一直困扰着许多工作者[69,70] 。
2.4.2 在大肠杆菌中表达外源蛋白的优化[71]
1)翻译效率的优化:启动
有效启动翻译需要起始密码上游的核糖体结合位点。翻译起始过程中,5~9个核苷酸长的Shine-Dalgarno序列与16S RNA的3'末端发生作用。Shine-Dalgarno序列与起始密码ATG之间的距离对翻译效率有影响,在ATG下游插入开放阅读框架的载体,此段距离已经优化,如果克隆基因以自身的ATG起始翻译,起始密码应位于Shine-Dalgarno序列下游5~7个核苷酸。
翻译起始区的二级结构也影响基因表达效率。Chen等通过改变Shine-Dalgarno序列上、下游的核苷酸,减少二级结构的形成,提高了基因表达水平。与此类似,也有一些基因通过共翻译,也就是在一段翻译序列的下游插入目的基因编码序列,提高了表达水平。
2)密码子的使用
遗传密码与氨基酸并不是一对一的关系,61种密码子编码20种氨基酸,而其中只有两种是由单一密码子编码的,其余的18种中的每一种都有多个密码子,编码同一种氨基酸的不同密码子的使用频率也是不同的。
如果编码区中有大量的或成串儿的稀有密码子,通过突变或基因重合成去除这些稀有密码子,可以提高表达水平。另外,如果靶序列中有稀有密码子AGA或AGG,会带来一些特殊问题,因为它们在编码区内部又形成额外的Shine-Dalgarno序列。
编码外源蛋白氨基酸的序列对表达水平也有很大影响。因此有必要用聚合酶链反应(PCR)或定点突变的方法,把表达基因N端的7~8个密码子变成大肠杆菌中最常用的密码子。还应尽可能通过这些方法将靶基因5'端(G+C)含量降至40%以下。
3)培养条件优化
在表达系统相同的情况下,不同的培养基常导致表达水平的巨大差异。LB类标准培养基可以用于建立表达的基本参数,但只有对培养条件进行优化后,才能获得最佳表达,包括使用基本盐培养基,如M9,限定盐培养基,如诱导培养基,或丰富培养基,如肉汤、YT或NZCYM。
一些培养基添加剂能提高某一种特定蛋白的表达水平。这其中包括浓度在0.1~0.5 mol/L之间的NaCl、不可代谢糖如蔗糖(0.2~0.6 mol/L)、辅助因子(血红素)和抗生素。Lee和Beckwith注意到,分泌途径缺陷的抑制基因位于与蛋白质合成有关的基因上,这些抑制突变的最终效果是降低蛋白合成速率,而低浓度抗生素能在大肠杆菌中模拟它的作用。表达外源蛋白尤其是分泌蛋白时,在培养基中加入抗生素,如氯霉素(1 μg/ml)和四环素(0.1 μg/ml),能降低蛋白合成速率,防止分泌系统过载,分泌蛋白也就更容易与伴侣分子等结合,折叠成天然构象。最后,培养基的pH也能影响外源蛋白的表达,当LB培养基的pH降至5.5以下时,可溶性的α-葡萄糖苷酶的表达量显著提高。极端pH可能会使细胞生长速率降低,从而防止细菌表达/加工系统过载。
在克隆基因的上游插入强的可调节启动子和有效的核糖体结合位点,可以在细菌中表达非融合蛋白。融合蛋白能大量制备,易于纯化,而且能赋予蛋白新的免疫学或生物学分析反应特性。
2.5 六聚组氨酸融合蛋白的纯化
近年来,随着蛋白质组学研究的,基因工程重组蛋白的分离纯化技术显得尤为重要,要将目标蛋白从复杂样品中快速、特异地纯化出来,就需要选择合适的蛋白纯化方法。
融合标签技术是20世纪末兴起的一种基于报告基因的重组DNA技术。融合标签技术的发展使重组蛋白质的纯化更加快速、简便,并很快得到了应用。目前常用的蛋白纯化标签是GST(谷胱甘肽巯基转移酶),6×His(六聚组氨酸)和表位标签(如FLAG是专为蛋白纯化和检测设计的八肽,HA是流感病毒血凝素表位等),其中6×His最为常用,带有6×His标签的融合蛋白可利用固定化金属鳌合亲和层析和免疫亲和法进行纯化。
Porath于1975年首次提出固定化金属螯合亲和层析(IMAC)的概念[72],该法基于蛋白质表面的组氨酸、半胱氨酸、色氨酸等残基与固定化金属离子的相互作用而对蛋白质进行分离纯化。其中,组氨酸是与金属离子作用较强的氨基酸,含有多个组氨酸的蛋白质可在IMAC中有效保留,故人为设计的多聚组氨酸便成为最常用的蛋白质纯化标签[73]。
免疫亲和纯化是一种利用抗原抗体特异性可逆结合特性的技术,它具有高效、高收率、浓缩效应等优点。在众多蛋白质纯化技术中,免疫亲和纯化是十分关键的技术。标签融合蛋白可通过抗标签的单克隆抗体和多克隆抗体来纯化。多数免疫亲和纯化都使用单克隆抗体,但有两种类型的多克隆抗体可用于免疫亲和纯化,即针对合成肽(如6×His、FLAG标签等)或某种抗原的特定区域产生的抗体。在这两种情况下,由于结合到固定化抗体上的抗原位点局限在一个很小的区域,因此可实现有效的洗脱。目前已有商品化的特异性针对标签的单克隆抗体,但价格都比较昂贵。
重组蛋白在大肠杆菌(E. coli)高效表达时,往往以不溶的、无活性的蛋白聚集体,即包涵体(inclusion body)的形式存在于细胞内。必须从细胞内分离出包涵体,采用高浓度变性剂(如7.0 mol/L盐酸胍、8.0 mol/L脲)溶解包涵体,然后除去变性剂或降低变性剂的浓度,使包涵体蛋白得以复性,最后再用色谱法使目标蛋白质得到纯化。其中包涵体蛋白的复性和纯化是整个过程中的核心。
2.5.1 融合标签技术
1)融合标签技术
融合标签技术是20世纪末兴起的一种基于报告基因的重组DNA技术,其主要过程是利用重组DNA技术在靶蛋白编码基因的3'端或5'端融合某种标签的编码基因,通过适宜的宿主来表达重组蛋白质[74-78],表达的重组蛋白质可以通过融合的标签与包被在固相基质上的特异配基结合而进行纯化。融合标签技术的发展使重组蛋白质的纯化更加快速、简便。近几年,随着新的融合标签系统的开发,其功能逐渐多样化,除用于蛋白质纯化外,还用于蛋白质定位和检测等。
2)融合标签的种类
融合标签根据其分子量大小可分为两大类:大的蛋白质分子(或蛋白质结构域及其衍生物)和小的多肽片段。大的蛋白质标签有GST(谷胱甘肽巯基转移酶)、SPA(葡萄球菌蛋白A)和GFP(绿色荧光蛋白)等,它的使用会增加目标蛋白的溶解性,但在蛋白结晶和抗体产生等过程中,标签必须去除。小的多肽标签有6×His(六聚组氨酸)、HA(流感病毒血凝素表位)、c-myc(人c-myc蛋白表位)、FLAG(专为蛋白纯化和检测设计的八肽)等,多数情况下,由于多肽标签相对较小,对融合蛋白质结构影响小,不需要从融合蛋白质中切除,因而多肽标签较蛋白质标签更为常用。迄今为止,己有较为详尽地报道了各种融合标签[79,80],其大小从几个氨基酸到蛋白质不等,相互作用类型包括酶与底物、细菌受体与血清蛋白、六聚组氨酸与金属离子、抗原与抗体等[81]。
3)融合标签技术用于蛋白的纯化
融合标签技术用于重组蛋白质纯化已为大量实验所证实[82-86]。理论上,根据亲和纯化原理可定向设计使目标蛋白质与纯化基质之间不发生任何直接相互作用的融合标签,以避免由于这种直接相互作用造成蛋白质变性。目前已有许多不同的标签可供利用。它们利用了标签与固相配体间的相互作用,从而可从复杂的提取物中对标签融合蛋白进行选择性的结合和洗脱。目前常用的蛋白纯化标签是GST,His和表位标签。
最常用的标签是His标签,即多聚组氨酸。该标签由6~10个连续组氨酸组成,置于蛋白的氨基或羧基末端。His标签与其他标签相比有很多明显优势:①对金属离子如镍、钴有高度的选择性和亲和力[87];②与金属离子的结合不受变性剂(尿素、胍)的影响;③温和多样的洗脱条件(100~250 mmol/L咪唑,低pH,10 mmol/L EDTA)。目前已有各种商品化介质(Ni-NTA-Agarose,Ni-IDA-Agarose)提供。另外,抗His标签的单抗或多抗也被应用于His融合蛋白的纯化。
GST标签是用来从细菌表达系统中纯化蛋白较为成功的标签之一。在该系统中,GST与被标记的蛋白进行融合,融合后的蛋白可在许多表达系统中表达。GST和谷胱甘肽紧密结合,融合蛋白可通过谷胱甘肽固相柱纯化,洗脱未结合的蛋白后,结合蛋白可用含游离的谷胱甘肽缓冲液进行洗脱。该系统中被融合的目标蛋白常可正确的折叠成为有功能的区域,故十分有用。该系统的另一个优势是可快速、温和地纯化,且配体谷胱甘肽的成本较低。
表位标签(HA、c-myc和FLAG等)也已广泛用于融合蛋白的纯化研究。目前已有商品化针对表位标签的单克隆抗体。为使标签在纯化中发挥良好的作用,在纯化过程中应尽量避免使用剧烈的条件使抗体和标签之间解离,剧烈的条件可使抗原发生不可逆变性,目标蛋白的回收率低。用游离多肽竞争洗脱法洗脱结合在固相抗体上的标签融合蛋白,是优选的方法。
4)融合标签技术在其他领域的应用
融合标签可提高重组蛋白的产量,由于外源蛋白质对于宿主菌的异质性,当外源蛋白质在宿主菌内表达时,宿主菌会调动各种机制来阻止外源蛋白质过量表达,导致的直接后果就是我们所需要的目标蛋白质表达量降低。近几年的研究发现,当外源蛋白质融合某些特定的标签后,能够有效增加重组蛋白质的产量[88-90]。
融合标签还可增强重组蛋白质的可溶性,外源蛋白质在宿主菌内表达时大多以包涵体形式存在[91],致使很难获得大量有活性的天然蛋白质。为了防止包涵体形成,一般可以采用低温诱导表达蛋白质,但这种方法并非对所有蛋白质都有效。研究发现,一些高度可溶的蛋白质在与其他蛋白质融合后会促进融合蛋白质以可溶形式表达,如MBP等[92,93]。
2.5.2 金属螯合亲和层析技术
1)金属螯合亲和层析技术的发展
1948年,Hearon发现水溶液中组氨酸和半胱氨酸可与Cu2+,Zn2+形成稳定的复合物。研究还发现,固定在凝胶上的金属离子Cu2+或Zn2+可与蛋白质表面裸露有咪唑基或巯基的氨基酸残基结合。因此,含有金属离子Cu2+或Zn2+的凝胶可用来选择性吸附表面含有组氨酸或半胱氨酸的多肽或蛋白质。
1961年,Hellferich提出以固定于载体的金属离子来分离小分子的概念,称为配基交换层析(ligand exchange chromatography,LEC)[94,95]。
1975年,Poroth首次提出“固定化金属螯合亲和层析(Immobilized Metal-Chelated Affinity Chromatography,IMAC)”的概念[72],首次成功地在琼脂糖凝胶上偶联了螯合配基亚氨基二乙酸(IDA)。IDA与金属离子如Cu2+螯合后,可与蛋白质结合,不同组成的蛋白质与金属离子结合力不同,据此将蛋白质进行分离。最常用的金属离子包括Cu2+,Ni2+,Zn2+和Co2+等过渡态金属离子。不同蛋白质分子内的组氨酸、半胱氨酸以及色氨酸等残基种类、数量、位置和空间构象不同,因而与金属配基的亲和力大小不同,从而可选择性地加以分离纯化。
1987年,Hochuli等[96]在目标蛋白质末端接上六聚组氨酸多肽得到纯化的重组蛋白质。此后六个组氨酸标签广泛应用于重组蛋白质的纯化。近年来,原核生物表达的重组蛋白质已有50%以上都是通过末端接有六聚组氨酸多肽而被纯化出来[97]。
目前,固定化金属螯合亲和层析技术已成为蛋白质,特别是基因重组蛋白和多肽分离纯化最有效的工具之一。
2)金属螯合亲和层析作用原理
固定化金属螯合亲和层析基于蛋白质表面氨基酸与固定化金属离子的亲和力不同对蛋白质进行分离。金属螯合亲和介质与蛋白质的作用如图2.1所示。过渡态金属离子能与供体氮、硫、氧等原子以配位键结合,金属离子上剩余的空轨道是电子供体的配位点,在溶液中被水分子或阴离子占据。当蛋白质表面氨基酸残基与金属离子的结合力较强时,氨基酸残基的供电原子(如组氨酸残基的N原子、半胱氨酸残基的S原子)将取代与金属离子结合的水分子或阴离子,与金属离子形成复合物,从而使蛋白质分子结合在固相介质表面。氨基酸中的α-氨基和α-羧基,以及某些氨基酸侧链基团含有孤对电子的活性原子都能参与螯合反应,由于蛋白质表面这些氨基酸的种类、数量、位置和空间构象不同,因而与金属配基的亲和力大小不同,从而可选择性地加以分离纯化[98]。
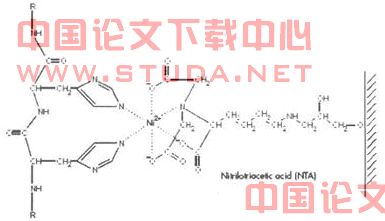
图2.1 金属螯合亲和介质与蛋白质的作用
生物分子与金属离子间的结合强度与它们的轨道重叠程度有关,结合作用可分为三种[99-100]:
(1)静电吸引:修饰后的基质带有净负电荷,它可吸附分离表面氨基酸残基带正电荷的蛋白质。
(2)配位键结合:蛋白质表面的组氨酸、色氨酸、半胱氨酸等残基上有咪唑基、吲哚基、巯基等,其氮原子、硫原子上未共用电子对与固定化金属离子形成配位键。
(3)共价键结合:固定化金属离子与蛋白质表面含硫基团作用形成共价键。
蛋白质与金属离子亲和力不同可用Pearson的软硬酸碱理论来解释[101]。该理论认为两个原子相互作用成键时,其中一个原子作为路易斯酸,另一个作为路易斯碱。根据软硬酸碱理论,金属离子如K+、Ca2+、Mg2+、Fe3+属于硬酸;单价金属离子如Ag+、Cu+归类为软酸;过渡态金属离子如Cu2+、Co2+、Ni2+、Zn2+属于中间酸。相应的,与金属离子结合的配基如氨基酸或蛋白质可分为三类碱,其中含氧原子(如羧基)、脂肪族的氮原子(如天冬氨酸和谷氨酸)和磷原子(如磷酸化的氨基酸)的配基属于硬碱;含硫原子(如半胱氨酸)的配基属于软碱;含芳香族氮原子(如组氨酸、色氨酸)的配基属于中间碱。中间酸Cu2+、Co2+、Ni2+、Zn2+可与含芳香族氮原子(如组氨酸、色氨酸)的中间碱以及半胱氨酸结合。由于蛋白质表面裸露氨基酸中半胱氨酸极少,因此组氨酸残基是与过渡态金属离子结合的主要基团[102]。
六聚组氨酸融合蛋白在金属螯合亲和层析介质表面结合和解离流程如下:
(1)将螯合配基以共价结合的方式固定在固相载体上。
(2)加入含有金属离子如Co2+、Ni2+的溶液,金属离子会与螯合配基形成配位键而固定在固相载体上。
(3)加入含有六聚组氨酸融合蛋白的溶液或发酵液,使六聚组氨酸融合蛋白与金属离子间以配位键方式结合在固相载体上,而与金属离子没有作用力的蛋白被分离出去。
(4)洗脱结合在固相载体上的六聚组氨酸融合蛋白。对金属螯合亲和层析介质上所结合的六聚组氨酸融合蛋白常用pH值(pH 4~5)或含咪唑的溶液进行洗脱,低pH可减弱蛋白和金属离子的相互作用,使六聚组氨酸融合蛋白得以洗脱,而咪唑是竞争性取代剂,可置换结合在介质上的六聚组氨酸融合蛋白,较低的pH和咪唑互相配合可更好地使六聚组氨酸融合蛋白被洗脱[103]。
3)金属离子的选择
金属离子的配位数直接影响其与螯合配基及生物分子的结合,配位数既要保证能与螯合配基形成稳定的化合物,又要保证有剩余的位点与目标蛋白的氨基酸残基结合。由于金属离子所带电荷、离子半径等不同,对蛋白质呈现不同亲和力,目前常用金属离子有Cu2+、Co2+、Ni2+、Zn2+等,它们具有相同电荷,离子半径分别为69、72、74和74pm。半径越小,配位作用越强,与蛋白质形成的络合物越稳定。因此,Cu2+对蛋白质结合力最强,Ni2+次之,Co2+和Zn2+结合相对较弱[104]。
4)金属螯合亲和层析用于生物分离纯化
1975年,Porath[72]首次用IMAC吸附牛血清蛋白,至今用IMAC已成功分离纯化出数百种生物大分子。IMAC分离技术除用于生物分离纯化外,还用于蛋白质的复性和空间定位、酶的固定化和金属离子清除等。
IMAC在生物分离纯化方面的优点:①结合力强,蛋白结合容量大,可用于生产,如采用IMAC吸附介质的扩张床吸附(EBA)技术可从哺乳动物细胞培养粗提物中一步分离纯化溶解性目标蛋白[105,106];②洗脱条件温和,再生后配体恢复完全,一种IMAC树脂可再生几百次而不改变其层析特性[107];③价格便宜;④可通过改装各种金属离子,引入目标蛋白质最适宜的金属离子进行不同蛋白质的纯化。鉴于上述特点,IMAC不仅适用于某些蛋白质、酶、氨基酸及肽的分离纯化[108],也适用于可逆螯合金属离子的核苷酸[109]、激素[110]、抗体[111]等物质的分离和纯化。
目前,基因工程重组蛋白纯化技术己经成熟,常通过DNA重组技术对蛋白进行标记,该方法在重组蛋白质表达过程中巧妙地将标签(常为6×His尾巴)直接连接到蛋白质的N-末端或C-末端,这种基因工程蛋白与裂解液中的其他蛋白质相比,对金属离子有更高的特异性,在分离纯化后再用化学法或酶法将尾巴切掉。这种方法目前已经成为基因工程下游技术中对融合蛋白纯化最常用的方法。国外公司已推出商品化试剂盒,美国Qiagen公司提供的QIAexpress系统就是较为经典的一种。该系统利用的pQE系列载体不仅有6个His编码序列还含有强启动子和多克隆位点等组成,可将目的基因在宿主细胞中高效表达。表达后的产物可直接用金属螯合亲和层析进行分离,有时可实现一步纯化。金属螯合亲和层析过程既可以在常规的非变性条件下进行纯化,还可以用于变性条件(6 mol/L盐酸胍或8 mol/L尿素)纯化,这对以包涵体形式存在的重组蛋白尤为有利。