增溶瑞香素的稳定囊泡作为药物载体的研究
作者:胡长刚 王仲妮 李干佐 谢辉 安娅 张笑一 廖莉玲
【摘要】 目的 探讨增溶瑞香素的稳定囊泡作为药物载体的优越性。方法 选择生理上能接受的2种表面活性剂,即仿生磷酯阳离子表面活性剂PTA与阴离子表面活性剂SDS,按一定比例复配能自发形成稳定性囊泡,用负染色透射电镜和动态光散射对其进行表征,并以其作为药物瑞香素的载体开展其组成、温度对包封率的影响,以及在模拟胃液及模拟肠液中的释放情况的研究。结果 在表面活性剂总浓度为5.0×10-3mol/L,PTA/SDS=3∶7时,囊泡粒径最大为151.1nm,包封率最高为28.2%。它们在模拟胃液和模拟肠液中释放75%的时间分别为240min和340min。结论 本研究对于阴阳离子表面活性剂复配自发形成囊泡作为药物载体进行了探索性工作,并对实验现象和结果从理论上进行讨论,为今后的研究指出方向。
【关键词】 囊泡 瑞香素 粒径 包封率 释放分数 药物载体
【Abstract】 Objective To study drug delivery of the stable vesicles with daphnetin solubilization.Methods Stable vesicles were formed from mixed solution of cation surfactant PTA and anion surfactant SDS at proper proportions. The formation and characters of the vesicles were demonstrated by negative-staining TEM and dynamic light scattering. Using the vesicles as the delivery of daphnetin, we carried out the research on the effect of formation and temperature upon entrapment efficiency. Research had also been carried out upon the release circumstance of daphnetin contained in the vesicles in simulated gastric and intestinal fluid.Results The results showed that entrapment efficiency of the vesicles reached a max of 28.2%, and the diameter reached a max of 151.1nm when the total concentration of surfactants were 5.0×10-3mol/L,PTA/SDS=3∶7. In simulated gastric and intestinal fluid ,the time for the release rate of daphnetin containing vesicles reaching 75% were respectively 240 minutes and 340 minutes.Conclusion This study has made an exploration research on utilizing vesicles spontaneously-formed from mixed solution of cation surfactant and anion surfactant as drug delivery, and a theoretical exploration is also presented in this paper about the phenomena and results of experiment.
【Key words】 vesicle daphnetin diameter entrapment efficiency release percent drug delivery
由于阴阳离子表面活性剂复配必然产生强烈的电性作用,因而使表面活性大大提高,显示出极大的增效作用,因此渐渐地应用于实际[1]。囊泡作为分子有序组合体的一个重要分支,被广泛地应用于模拟生物膜[2],合成纳米材料[3]、作为微反应器[4]和药物载体[5]等科技领域。囊泡作为药物载体具有防止药物降解失活,延长药物的作用时间以及降低毒副作用等特点,因而囊泡包封技术已经成为化学、药学和生命研究领域中的热点课题之一。但通常制备囊泡的方法需要外界提供额外的能量,如超声波法[6]、手摇法(溶媒蒸发法)等,其中手摇法的包封率约为10%,超声波法对于水溶性药物的包封率约为20%[7]。然而这些方法得到的囊泡是热力学的不稳定体系,从而限制了其应用。为此自发形成囊泡就成为研究人员追求的目标。1989年,Kaler和Zasadzinski[8]从复配的阴阳离子表面活性剂体系得到了自发形成的囊泡。这种囊泡为上述应用创造了条件。笔者也用仿生磷酯类阳离子表面活性剂磷酸三酯(PTA)与阴离子表面活性剂十二烷基硫酸钠(SDS)复配首次获得自发形成的囊泡[9]。前期重点研究了囊泡大小,稳定性及形成机制,结果表明,这种囊泡稳定性好,其大小、电荷和渗透性等容易通过改变2种表面活性剂的比例来调节,制备速度快。由于PTA属于仿生类磷酯,对于胺类阳离子表面活性剂对眼和皮肤有刺激性,但是分子接上乙氧基或羟丙基等基团,刺激性显著降低。即增加100倍的浓度(10%)才具有相当最初胺类0.1%浓度时的刺激性,因此可用于药物中[10]。而SDS早以用于牙膏、搽剂,乳膏剂中,只有浓度高时对皮肤有刺激,刘程等学者[11]提到表面活性剂对药物影响中,谈到吐温80,SDS能影响含磺酰胺片剂的溶解性,使药片的粘结性降低,在胃酸中较快溶解,改善了药片的崩解、溶解和吸水性。因此本文通过改变2种表面活性剂的比例,把在磷酸二盐(PBS)缓冲溶液中得到系列囊泡作为瑞香素药物载体,开展其性能、包封率、缓释率等研究,为自发囊泡作为药物载体进行应用性探索。目前国内在这一方面的研究尚未见报道。
瑞香素(daphnetin)又称祖师麻甲素是一种微溶于水的香豆素类化合物,其分子结构见图1。
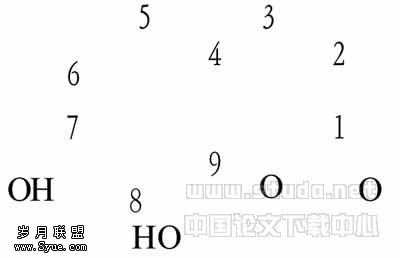
图1 瑞香素的分子结构
瑞香素临床上主要用于血栓栓塞性脉管炎、风湿性关节炎、冠心病以及中药麻醉剂[12]。本文研究了仿生磷酯类阳离子表面活性剂磷酸三酯(PTA)与阴离子表面活性剂十二烷基硫酸钠(SDS)以不同配比(mol/mol)复配自发得到单室囊泡,采用透射电镜对囊泡形态进行了观测。并利用动态光散射测定了囊泡的粒径及多分散度,用不同配比下形成的囊泡对瑞香素的包封及其缓释作用进行了研究。
1 材料与方法
1.1 仪器和试剂 透射电镜(TEM,型号JEM-1200EX);动态光散射(DLS,型号BI-200SM,Brookhaven Instruments Co.,Holtsville,NY);BI-9000AT数字相关器;UV-2100型紫外/可见分光光度计(北京瑞利分析仪器公司)。透析袋(分子量8000~10000,山东省济南市爱伯公司);阳离子表面活性剂磷酸三酯(PTA,O=P[OCH2CH(OH)CH2-CH2-N+(CH3)2-C12H25]3·3Cl-),南京金陵石化研究院提供,纯度>98.5%;阴离子表面活性剂十二烷基硫酸钠(SDS),Fluka Co., 纯度>98.5%;瑞香素粗品(长春春城制药厂);水为3次蒸馏水;其余无机试剂均为分析纯试剂;模拟胃液(pH=1.2)、模拟肠液(pH=7.5)、磷酸二氢盐与磷酸氢二盐缓冲溶液(pH=7.41;PBS)均按[7]配制。
1.2 实验方法
1.2.1 囊泡的制备及囊泡形态的观测 配制PTA和SDS的母液,分别取适量的表面活性剂溶液混合至目标比例和浓度(表面活性剂总浓度Ctotal=0.005mol/L),轻微摇晃均匀,混合体系呈现淡蓝色,预示着囊泡的自发形成[9,13]。采用负染色法透射电镜对囊泡进行表征。
1.2.2 囊泡粒径及多分散度的测定 动态光散射的入射波长为488nm。在温度为25℃,散射角为90°等条件下进行测定。
1.2.3 瑞香素的纯化 见文献[12]。
1.2.4 瑞香素及其空白囊泡溶液的紫外—可见光谱扫描 精确配制含5.0×10-3mol/L的瑞香素溶液及表面活性剂总浓度Ctotal=5.0×10-3mol/L(PTA/SDS=7∶3)空白囊泡溶液,分别用PBS缓冲溶液(pH=7.41)稀释5倍得到待测样品,在UV-2100型紫外/可见分光光度计上从220~500nm间进行扫描,其目的是寻求瑞香素的最大吸收峰,并了解空白囊泡是否对药物分子测定有干扰。扫描结果表明瑞香素在325nm、263nm处有吸收峰(图2中b线的1、2两处),与文献报道(324nm,262nm)相吻合[12]。由于瑞香素在325nm处吸收峰明显且峰形好,为此本文选用325nm(图2中b线的1处)作为用透析法来测定瑞香素缓释率的吸收波长。同时笔者在相同的波长范围内测定了瑞香素溶液和空白囊泡的一阶导数光谱,结果见图3。图3的a线是空白囊泡的一阶导数曲线,是数值基本为0的一条直线。b线为波形,是瑞香素的一阶导数曲线,从1、2、3、4四个峰形来看,选择3处波长(即306nm)测定瑞香素的导数值,此时空白囊泡对药物分子吸收峰基本不产生干扰。故本文选用306nm作为用一阶导数法来测定瑞香素包封率的吸收波长。
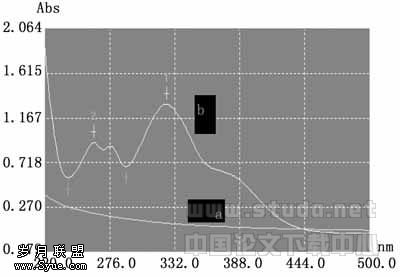
a—空白囊泡;b—瑞香素
图2 瑞香素和空白囊泡紫外光谱图
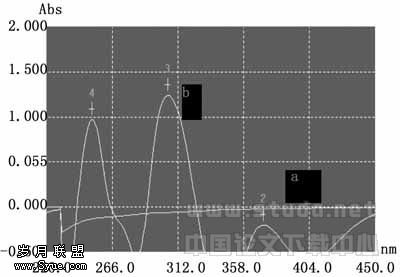
a—空白囊泡;b—瑞香素
图3 瑞香素和空白囊泡的一阶导数紫外光谱图
1.2.5 瑞香素一阶导数标准曲线和零阶导数标准曲线的绘制 在上述配制的瑞香素母液(5.0×10-3mol/L)中,分别取出80、160、200、240、280、320μl分别置于相应的10ml容量瓶中,再用PBS溶液(pH=7.41)稀释到刻度,在306nm处测定瑞香素的一阶导数值并绘制标准曲线,其线性回归方程为(1)式。按同样方法取瑞香素母液分别置于另一批容量瓶中,再用水稀释到刻度在325nm处分别测定系列浓度瑞香素溶液的吸光度,绘制标准曲线其线性回归方程为(2)式。
C=0.0942A+2×10-6(mg/ml) R2=0.9993 (1)
C=0.0195A-0.0001 (mg/ml) R2=0.9998 (2)
1.2.6 样品的制备及包封率的测定 向试管中加入4ml 0.005mol/L(含瑞香素0.356mg)的瑞香素溶液后,分别从事先配制好的PTA和SDS母液中按不同比例取量,但保持两者总浓度(Ctotal=0.005mol/L)不变。轻微振荡试管后,即得淡蓝色的含药物瑞香素的囊泡溶液。
药物包封率的测定有多种方法,本实验选择一阶导数分光光度法。它具有快速、准确、方便等特点[14~17]。准确量取2ml上述制备好的瑞香素包封溶液置于10ml容量瓶中,用PBS溶液稀释至刻度后迅速在306nm处测定上述溶液的一阶导数值。将该值代入方程(1)中算出游离药物质量,则由(3)式瑞香素囊泡溶液的总包封率。
总包封率=1-游离药物质量×稀释倍数〖〗投料的药物总量×100% (3)1.2.7 囊泡中瑞香素的释放研究 囊泡包封药物缓释率的研究通常采用透析法[7,18],取10ml包封药物的囊泡置于透析袋中,加入与袋外相同的模拟胃液或模拟肠液以维持透析袋内外的离子强度相等。将透析袋放入盛有100ml模拟胃液或模拟肠液的广口瓶中,将瓶置于37℃水浴中,袋外开始轻微搅拌。每隔一定时间,从袋外取2ml透析液在325nm处测量吸光度,然后放回瓶中,直至吸光度不变为止,即视为达到扩散平衡,解开透析袋,将全部溶液倒入瓶中,测其吸光度。按同样方法,将同浓度瑞香素直接放入袋内,测定不同时刻的吸光度。测量结果代入(2)式计算出某一时刻释放药物的质量,再按(4)式计算缓释率。从而测量瑞香素囊泡包封物和纯瑞香素溶液的释放情况。但是为了实用和方便,笔者测定释放药物浓度为75%的时间去衡量,时间越长,说明这种体系的缓释效果越好。
缓释率=t时刻包封在囊泡中药物〖〗通过渗透膜的药量〖〗t时刻未包封药物通过〖〗渗透膜的药量×100% (4)2 结果
2.1 囊泡制备的表征
2.1.1负染色照片 从负染色照片(图4)可看出,未包封药的囊泡形状大多为规则的球形,而包封瑞香素的囊泡的形状大多数均为规则的椭球形或球形,粒径为100~150nm左右,这与表1光散射所得数据是吻合的。
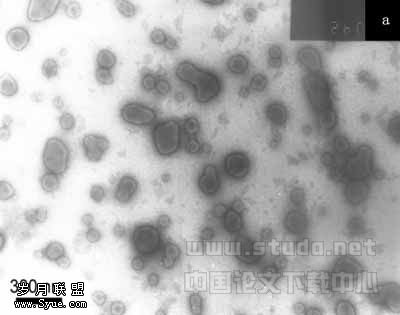
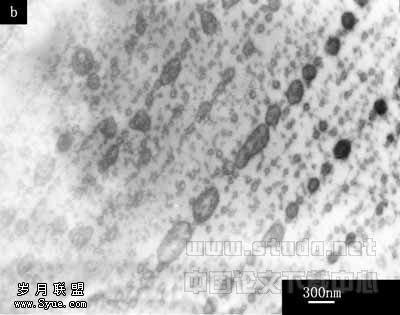
a—空白囊泡;b—包封瑞香素的囊泡
图4 PAT/SDS囊泡负染色TEM照片
2.1.2 囊泡的粒径及多分散性的研究 使用动态光散射来测定不同配比的囊泡体系及瑞香素囊泡包封物的粒径和多分散度,结果见表1。
表1 不同配比时PTA/SDS(mol/mol)囊泡的粒径和多分散度
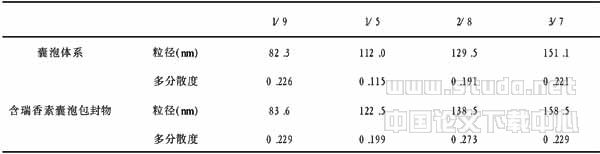
从表1中数据可知,空白囊泡的粒径随PTA的比例增大,囊泡的粒径也增大,这可以通过阴阳离子表面活性剂的“离子对”及其曲率来解释。单独PTA分子由于其曲率比较大,聚集体只能是胶束;当适量的PTA分子与SDS分子混合后,由于静电吸引形成离子对且满足了囊泡形成对分子结构的需要,从而改变了聚集体的曲率。也就是说,PTA分子穿插于SDS分子之间,使得曲率变小而粒径增大,导致囊泡形成,但此时粒径还比较小。随着越来越多的PTA分子穿插入SDS之间,曲率越来越小,粒径也就越来越大;在比例为PTA/SDS=3∶7时粒径最大。而含瑞香素囊泡包封物的粒径变化也是一样的,其粒径与相应比例的空白囊泡粒径略有增大,这是由于瑞香素增溶于囊泡的双层之中。另外,大多数增溶瑞香素的囊泡体系的单分散度较好,其多分散度在0.2~0.28之间,说明囊泡大小比较均匀,粒径分布较窄。
2.2 囊泡的包封率研究
2.2.1 囊泡的组成对包封率的影响 在药物质量均为0.356mg及表面活性剂总浓度均为Ctotal=0.005mol/L的条件下,改变PTA与SDS的比例,研究了PTA/SDS(mol/mol)分别为1∶9,1∶5,2∶8,3∶7时囊泡的包封率,结果见图5。随着PTA与SDS比例增加,囊泡对药物瑞香素的包封率也逐渐增大,这与相应的粒径变化是一致的。当PTA/SDS=3∶7空白囊泡的粒径最大为151.1nm,而含瑞香素囊泡包封物的粒径相应为158.5nm,此时包封率也达最高为28.2%;当PTA/SDS=1∶9时空白囊泡的粒径最小为82.3nm,此时包封率最低为19.4%,说明该体系自发形成的囊泡对药物具有一定的包封作用。同时由表1和图5可知,囊泡的大小,组成具有可调节性,在实际应用中可按所希望的要求设计。但是由于阴阳离子表面活性剂复配后使表面吸附层分子排列更加紧密,在一定程度上提高了药物分子在其表面的吸附量,因而药物分子可能部分增溶进入了囊泡的双分子层,同时部分则被吸附在囊泡的表面。瑞香素分子具有一定的极性,因而被吸附在囊泡表面的瑞香素分子周围有许多水化分子,阻止了未进入囊泡的药物分子进一步增溶至囊泡的双分子层中去,因此造成包封率不是太高。
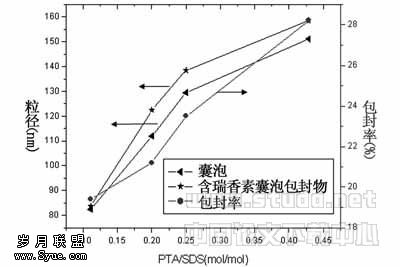
图5 不同组成和粒径对包封率的影响
2.2.2 囊泡包封物热稳定性的研究 陈文君[9]将PTA/SDS复配体系自发形成的囊泡加热至90℃,在高温下保持恒温2h,再冷却至室温,体系仍然有囊泡。因此笔者也考查了温度对囊泡的包封率的影响。在药物质量均为0.356mg,表面活性剂总浓度为Ctotal=0.005mol/L,而PTA/SDS=3∶7的条件下,将瑞香素包封物用PBS缓冲溶液(pH=7.41)稀释相同的倍数后,分别将样品加热至25℃、35℃、45℃、55℃、65℃后,测定样品包封率。结果见图6。由实验结果可知温度升高,包封率有所下降,这可能是由于温度升高时,囊泡双层膜的流动性增强,造成包封药物渗漏,但包封率的下降幅度比较小,这也说明了该囊泡包封物具有较好的热稳定性。
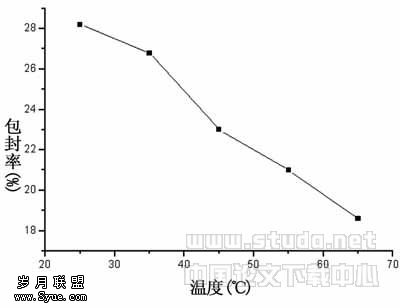
图6 温度对包封率的影响
2.3 囊泡缓释效率的研究 药物质量均为0.356mg,以PTA/SDS=2∶8,3∶7(mol/mol),表面活性剂总浓度Ctotal=0.005mol/L的囊泡包封物分别测定在模拟胃液和模拟肠液中的释放,在各种条件下的药物释放曲线见图7,不管是在模拟胃液还是在模拟肠液中,没有载体的药物释放最快。以药物释放75%时所需时间为例进行比较可知:(1)药物在囊泡中释放时间比没有载体要长;(2)在胃液中释放时间不如肠液长,例如在PTA/SDS=3∶7体系中,在胃液和肠液中释放的时间分别增加6倍和3.4倍;(3)在PTA/SDS的组成配比上,以3∶7的缓释作用最为明显。
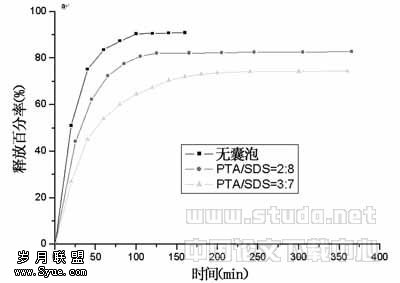
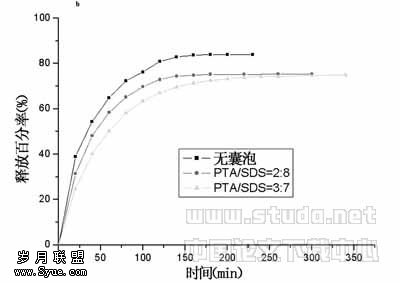
图7 囊泡包封物在模拟胃液
(a)和模拟肠液(b)中的缓释曲线
3 讨论
由上述实验结果可以得出下列结论:(1)PTA/SDS体系自发形成的囊泡可以包封药物瑞香素,且制备简单,结构确定。在表面活性剂总浓度为Ctotal=0.005mol/L,PTA/SDS=3∶7时,包封率最高为28.2%。(2)囊泡的结构(大小、组成、渗透性等)具有可调节性。粒径增大,其包封率也增大;升高温度对囊泡包封物无明显的破坏作用,其包封率有所下降,但幅度不大。(3)该体系的囊泡包封物在模拟胃液或模拟肠液中均具有一定的缓释作用。(4)这种自发形成的囊泡可作为药物载体,但是包封率不是很高,缓释倍数有限。说明三头三尾巴的阳离子表面活性剂PTA与单头单尾巴的阴离子表面活性剂SDS,按一定比例复配自发形成的囊泡对药物瑞香素的增溶能力不是太理想,为今后在表面活性剂选择方面的研究工作指出方向。
【】
1 赵国玺,朱步瑶.表面活性剂作用原理.北京:轻出版社,2003,356-383.
2 Fendler JH著,程虎明,高月英译.膜模拟化学.北京:出版社.1991,147-149.
3 Youn HC, Subbash B, Fendler J H. Dihexadecyl phosphate, vesicle-stabilized and in situ generated mixed cadmium sulfide and zinc sulfide semiconductor particles: preparation and utilization for photosensitized charge separation and hydrogen generation.J Phys Chem,1988,92:6320-6325.
4 Toyoki Kunitake, Yoshio Okahata. A totally synthetic bilayer membrane.J Am Chem Soc,1977,99:3860-3867.
5 MJ Ostro(ed.). Liposomes: from biophysics to therapeutics. New York:Marcel Deker, 1987.
6 Carmona-Ribeiro AM, Yoshida LS, Chaimovich HJ, et al. Permeabilities and stabilities of large dihexadcylphosphate and dioctadecyldimethylammonium chloride vesicle. Journal of Colloid and Interface Science, 1984,100:433-437.
7 杨艳红, 郝永梅, 赵凤林,等.非离子表面活性剂囊泡包封药物头孢唑啉钠的研究.化学通报,2002,65(7):467-471.
8 Kaler EW, Murthy AK, Rodriguez BE,et al. Spontaneous vesicle formation in aqueous mixtures of single-tailed surfactants. Science, 1989, 245:1371-1377.
9 陈文君. 囊泡的自发形成及动态表面张力的研究.济南:山东大学博士,2003,61-69.
10 Culter RA,E Jungerman. Cationic Surfactant.New York: Marcel Dekker,1970,527-531.
11 刘程, 江小梅, 李宝珍,等. 表面活性剂应用大全.北京:北京工业大学出版社,1992,345-349.
12 廖莉玲. 瑞香素—金属配合物及其抗炎活性研究.西安:陕西师范大学硕士学位论文,1991,11-14.
13 Bevqmeier M, Hoffmann H, Witte F,et al.Vesicles from single-chain hydrocarbon surfactants and perfluoro cosurfactants. Journal of Colloid and Interface Science, 1998,203:1.
14 张清明, 顾学裘, 沙沂, 等. 喜树碱多相脂质体包封率测定方法及渗漏的研究. 药学学报, 1987,22(12):918-922.
15 张强, 廖工铁, 李明艳. 一阶导数光谱法测定聚α-氰基丙烯酸正丁酯毫微粒中硫酸庆大霉素的包封率.华西医大学报,1994,25(3):353-357.
16 王绍宁, 邓意辉, 毕殿洲,等.阳离子交换树脂—一阶导数分光光度法测定盐酸环丙沙星脂质体包封率.沈阳药科大学学报,2002,19(3):192-195.
17 许琛琦, 兰蓉, 赵实,等. 一阶导数紫外光谱法测定脂质体中维生素E的含量. 日用化学工业, 1999,30(6):45-47.
18 Hu CJ, Rhodes DG. Proniosomes:A novel drug carrier preparation. International Journal of Pharmaceutics,1999,185:23-35.











