RNA干扰对肾癌细胞端粒酶活性及增殖、凋亡的影响
作者:郝林,郑骏年,李望,杨文发,刘俊杰,温儒民,陈家存,孙晓青
【摘要】 目的 探讨针对人端粒酶RNA(hTR)及其催化亚基(hTERT)的小干扰RNA(siRNA)对肾癌细胞端粒酶活性及其增殖、凋亡的影响。方法 将hTR?siRNA、hTERT?siRNA(100nmol/L)单独或联合转染人肾癌786?0细胞,采用RT?PCR法检测hTR、hTERT mRNA表达,TRAP?ELISA法检测端粒酶活性,MTT法检测细胞增殖,免疫组化TUNEL法检测细胞凋亡。结果 (1)hTR?siRNA可显著降低786?0细胞hTR mRNA表达(P<0.01),hTERT?siRNA可显著降低hTERT mRNA表达(P<0.01),但彼此互不影响。(2)二者均能显著抑制端粒酶活性(P<0.01,P<0.01),并增加786?0细胞增殖抑制率及凋亡细胞阳性率 (P<0.01,P<0.01)。二者联合应用与单独应用差异亦无显著性(P>0.05)。结论 hTR、hTERT siRNA通过抑制各自基因表达,抑制人肾癌细胞端粒酶活性,进而抑制增殖、促进凋亡。
【关键词】 肾癌;小干扰RNA;端粒酶RNA;端粒酶逆转录酶
of Proliferation and Induction of Apoptosis Key words:Renal neoplasm;Small interfering RNA; Human telomerase RNA;Human telomerase reverse transcriptase
0 引言
端粒酶被激活导致肿瘤细胞无限增殖,抑制端粒酶活性能使肿瘤细胞无法合成端粒而凋亡,因此是肿瘤的理想靶点[1]。端粒酶主要由端粒酶RNA(hTR)及端粒酶逆转录酶(hTERT)组成。端粒酶以hTR为模板合成端粒DNA,hTERT则是催化这一反应的唯一限速酶。RNA干扰能特异、高效阻抑靶基因表达,有望成为肿瘤基因治疗的有力工具。我们应用RNA干扰技术阻抑hTR、hTERT表达,观察其对肾癌细胞端粒酶活性及增殖、凋亡的影响。
1材料与方法
1.1材料
人肾癌透明细胞株786?0由本室保存。hTR?siRNA、hTERT?siRNA、阴性对照siRNA、siRNA转染试剂盒为美国Ambion公司产品。总RNA提取试剂盒、RT?PCR试剂盒为美国Promega公司产品。TRAP?ELISA端粒酶活性检测试剂盒购自Roche公司。原位末端凋亡检测试剂盒购自Santa Cruz公司。
1.2方法
1.2.1siRNA的设计、合成
由Ambition公司设计、合成针对人端粒酶hTR序列及hTERT基因显性失活突变体区(NM003219,碱基序列位置2182~2200)的siRNA。hTR序列如下:正义链: 5'?UUGUCUAACCCUAACUGAGtt ?3',反义链3'?ttAACAGAUUGGGAUUGACUC?5'。hTERT序列如下:正义链5'?CAAGGUGGAUGUGACGGGCtt?3'.反义链3'?ttGUUCCACCUACACUGCCCG?5'。经基因库检索确认与hTR、hTERT以外的基因序列无同源性。
1.2.2细胞培养及转染
786?0细胞于含10%FCS的RPMI?1640中常规培养48h,按转染试剂盒说明将hTR?siRNA、hTERT?siRNA调整到终浓度为100 nmol/L,单独或联合加入培养细胞内,另以生理盐水(空白对照)、脂质体、阴性对照siRNA作对照。培养24h后检测hTR/hTERT mRNA表达及端粒酶活性,72h后检测细胞增殖及凋亡。
1.2.3RT?PCR
提取总RNA,RT?PCR试剂盒一步法行RT?PCR反应。hTR上、下游引物序列如下:5'?CTGGGAGGGGTGGTGGCCATTT?3', 5'?CGAACGGGCCAGCAGCTGACAT?3'。hTERT引物:5'?GCCAGAACGTTCCGCAGAGAAAA?3',5'?AATCATCCACCAAACGCAGGAGC?3'。以GADPH基因作为内参照。取PCR产物于1%琼脂糖凝胶电泳,紫外照相并扫描分析,以hTR、hTERT/GADPH表达水平行半定量分析。
1.2.4端粒酶活性的测定
采用端粒重复序列扩增?酶联免疫吸附(TRAP?ELISA) 法进行检测,根据A=A450?A690端粒酶活性,并计算与空白对照组比值。具体步骤按说明书进行。
1.2.5MTT法检测细胞增殖
处理后786?0细胞加入MTT10μl/孔(5mg/ml),继续培养4h后吸弃上清。加入二甲亚砜100μl/孔,溶解甲瓒紫结晶,酶标仪570nm波长处测定吸光度A值,抑制率。
1.2.6TUNEL法检测细胞凋亡
786?0细胞于玻片上固定,洗片后与Triton?100共同孵育2min,滴加TUNEL反应混合液,在湿盒中37℃孵化1h,PBS洗3次,二氨基联苯染色,洗片后封片。高倍镜下随机计数5个视野,细胞核呈黄褐色即为阳性,计算阳性细胞百分比。
2结果
2.1siRNA对786?0细胞hTR、hTERT mRNA表达的影响
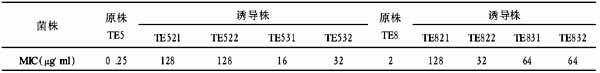
与阴性siRNA对照组比较,hTR?siRNA组hTR mRNA水平明显下调(P<0.01),hTERT mRNA水平无明显变化(P>0.05)。hTERT?siRNA组hTERT mRNA水平明显下调(P<0.01),hTR mRNA水平无明显变化(P>0.05),见表1。表1 hTR?siRNA、hTERT?siRNA对肾癌786?0细胞hTR、hTERT mRNA表达的影响(略)注:与阴性siRNA组比较,#P>0.05,*P<0.01
2.2siRNA对786?0细胞端粒酶活性的影响
hTR?siRNA和hTERT?siRNA均能明显抑制端粒酶活性(P<0.01),但二者比较差异无显著性(P>0.05)。联用组与单用组比较差异无显著性(P>0.05),见表2。表2hTR?siRNA、hTERT?siRNA对肾癌786?0细胞端粒酶活性及增殖、凋亡的影响(略)注:与阴性siRNA组比较,*P<0.01;三组之间两两比较,#P>0.05
2.3siRNA对786?0细胞增殖的影响
hTR?siRNA和hTERT?siRNA均能明显抑制786?0细胞增殖,二者比较差异无显著性(P>0.05)。联用组与单用组比较差异无显著性(P>0.05),见表2。
2.4siRNA对786?0细胞凋亡的影响
hTR?siRNA和hTERT?siRNA均能明显促进786?0细胞凋亡,二者比较差异无显著性(P>0.05)。联用组与单用组比较差异无显著性(P>0.05),见表2。
3讨论
端粒位于线性染色体末端,细胞每分裂一次端粒序列缩短50~200bp,当缩短至临界长度时细胞凋亡[2]。端粒酶是催化合成并维持端粒长度的一种核糖核蛋白,由端粒酶RNA(hTR)、端粒酶催化亚基(hTERT)组成,它能以hTR为模板,在hTERT催化下合成端粒,以弥补缩短的端粒[3]。癌细胞由于端粒酶的激活使染色体端粒维持在一定长度,一方面使细胞获得永生,另一方面使细胞周期缩短、生长变快[3]。研究证实针对hTR、hTERT的反义核酸能够通过抑制端粒酶活性,抑制多种肿瘤细胞增殖并诱导凋亡[1,4]。Kanaya等[5]报道hTR、hTERT在肾癌组织的检出率分别为80%、86%,且其表达与端粒酶活性呈正相关,而正常肾组织无hTERT表达,因此hTR、hTERT是肾癌基因的有效靶点。
RNA干扰是由小片断双链RNA(siRNA)介导的转录后基因沉默技术。siRNA进入细胞后与RNA诱导的沉默复合体(RISC)结合,并在RISC作用下特异性降解靶基因mRNA,其效率比单链反义RNA强100倍[6],因此siRNA可在体内外抑制癌基因表达,并抑制肿瘤生长[7]。本研究发现siRNA可抑制肾癌细胞hTR、hTERT基因表达,且具有高度特异性。hTR、hTERT表达抑制后,肾癌细胞端粒酶活性降低。二者抑制端粒酶活性作用相仿,联用亦不能增强抑制作用。我们的研究结果与Kosciolek在结肠癌、宫颈癌细胞中获得的结果一致[8]。
本研究还发现hTR?siRNA与hTERT?siRNA具有相似的抑制肾癌细胞增殖、促进凋亡作用,联合应用也不能增加其作用。肿瘤细胞端粒酶活性下降后,通常需要数周时间,肿瘤细胞经过数代分裂使端粒缩短至临界值后才能凋亡[9]。但如果肿瘤细胞的端粒加帽延长功能具有缺陷,肿瘤细胞也能立即出现增殖抑制、凋亡增加[10]。本研究siRNA处理后72h细胞即出现增殖抑制、凋亡增加,可能与786?0细胞端粒加帽延长功能缺陷有关。
【】
[1]许宁,赵忠文,石爱平,等.端粒酶反义寡核苷酸对肾癌细胞端粒酶活性及其体外增殖的影响[J].中华泌尿外科杂志,2000,21(6):331?333.
[2]Richard CA,Homagoun V,Christopher P.Telomeres length predicts replicative capacity of human fibroblasts[J].Proc Natl Acad Sci USA,1992,89(21):10114?10118.
[3]Holt SE,Glinsky VV,Ivanova AB,et al.Resistance to apoptosis is in human cell conffered by telomerase function and telomere stability[J].Mol Carcinog,1999,25(4):241?248.
[4]Zhang Y,He DM.Effect of antisense hTERT mRNA oligodeoxynucleotide on telomerase activity of leukemic cells [J].Cell Biol Int,2002,26(5):427?431.
[5]Kanaya T,Kyo S,Takakura M,et al.hTERT is a critical determinant of telomerase activity in renal?cell carcinoma [J].Int J Cancer,1998,78(5):539?543.
[6]Lipardi C,Wei Q,Paterson BM.RNAi as random degradative PCR:siRNA primer convert mRNA into dsRNAs that are degraded to generate new siRNAs[J].Cell,2002,107(4):297?307.
[7]Martinez LA,Naguibneva I,Lehrmann H,et al.Synthetic small inhibiting RNAs:Efficienct tools to inactivate oncogenic mutations and restore p53 pathways[J].PNAS,2002,99 (23):14849?14854.
[8]Kosciolek BA,Kalantidis K,Tabler M,et al. Inhibition of telomerase activity in human cancer cells by RNA interference [J].Mol Cancer Ther,2003,2(3):217?218.
[9]Hahn WC,Stewart SA,Brooks MW,et al.Inhibition of telomerase limits the growth of human cancer cells [J].Nat Med,1999,5(10):1164?1170.
[10]Kondo Y,Koga S,Komata T,et al.Treatment of prostate cancer in vitro and in vivo with 2 5A?anti?telomerase RNA component [J].Oncogene,2000,19(18):2205?2211.