药物难治性癫痫外科治疗的临床研究
作者:尹连虎 吴承远 曲元明
【摘要】 目的 本研究旨在探讨并完善对药物难治性癫痫的外科手术方法,并对影响疗效的因素进行统计学分析,期望确定影响预后的相关因素和各种癫痫发作的最佳治疗方案。方法 采用脑电图、CT、MRI等影像学技术,对53例不同发作类型需要手术治疗的难治性癫痫患者进行术前致痫灶定位,分别对患者行不同方法的手术治疗。结果 经过1~6年的随访,总有效率达90%。术后疗效与手术方式、癫痫的发作类型、起病年龄、发作次数、脑电图背景及智商等因素之间显著相关。结论 手术是解除或减轻药物难治性癫痫患者痫性发作的有效方法之一。
【关键词】 难治性癫痫 神经外科手术治疗 临床研究
Clinical study on the surgical management of intractable epilepsy
【Abstract】 Objective To investigate and perfect the surgical treatment methods of the intractable epilepsy.To analyze the relative factors with postoperative results,to determine the prognostic factors and the most favorable type of operations to each kind of epilepsy.Methods Epileptic focuses were determined by clinical manifestations,EEG,CT,MRI,etc.preoperatively.According to the localized focuses,53 cases were respectively performed on with different types of epilepsies.Results After a follow-up for 1~6 years (means 2.8 years),according to the criteria of International Antiepileptic Association:it showed that the surgical effective rate was 90%.The result showed that there was distinct relationship between effect and operation,seizure type,onset age,frequency,EEG and IQ.Conclusion Surgical management is an effective method that could eliminate or relieve intractable epileptic patients’ seizures.
【Key words】 intractable epilepsy neurosurgical treatment clinical study
癫痫作为一种临床上常见的综合征,是一个严重危害人类身心健康的医学难题。其临床患病率在5‰左右,现如今我国约有癫痫患者500~600万,其中约有100多万为单纯服用抗癫痫药物(AEDs)难以控制发作的患者,需要进行手术治疗。医学上将应用药物难以控制的癫痫称为药物难治性癫痫,而临床上一般将经过2年以上系统的AEDs治疗后,发作频率仍在每月4次以上的癫痫作为药物难治性癫痫的标准。近年来,对这类患者的外科治疗取得了肯定的进展,但是因手术标准、手术方法和仪器设备差别较大,所以治疗效果评价尚难定论。本研究术前采用多指标综合、严格地筛选,确定手术方法,选择最佳治疗方案,术中采用高精度刺激技术,综合评价手术疗效,并对相关因素进行了探讨。
1 资料与方法
1.1 一般资料 本组53例患者中,男34例,女19例。年龄5~74岁,平均25.8岁。发病年龄:0~5岁5例;5~10岁13例;10~15岁7例;15~20岁8例;>25岁20例。病程半个月~40年,平均12.3年。发作类型:全身强直阵挛性发作(GTCs)40例;复杂部分性发作(CPs)4例;GTCs+ CPs 4例;GTCs+简单部分性发作(SPs)5例。其中伴有精神障碍者7例,发育迟缓者4例,分别表现为智能减退、少语、淡漠、幻听、性情暴躁、人格及行为异常等。发作次数:每天>1次者5例;每周>1次者5例;每月>4次者7例;每月2~4次者22例;每月<2次者6例;每月<1次者8例;出现癫痫持续状态者3例。术前药物治疗:本组患者均正规应用AEDs治疗2年以上。其中服用单一AEDs者6例;联合2种AEDs者13例;2种以上者34例。其中23例患者服用过中草药治疗,8例患者出现过药物中毒现象。2例监测过血药浓度(血清),分别为苯妥英钠15.87μl/ml,卡马西平12μl/ml。智力测验(WAIS):28例患者术前、术后分别进行过韦氏智力量表测定,总分(FIQ)>90分者8例,80~90分者13例,70~80分者5例,<70分者2例。
1.2 术前致痫灶定位 电生理检查:术前均行常规脑电图(EEG)检查,包括头皮EEG、睡眠EEG、蝶骨电极和密集电极等。其中能定侧定位者29例,阳性率为29/53(54.7%),脑电图背景分析如下:正常3例;轻度异常5例,基本节律慢化及不规则化,各导联散在到低幅θ波,不呈节律,基本波波幅波律调节差;中度异常:21例,基本波波幅波律无调节,中至高幅θ波可呈节律出现;重度异常24例,α波消失,中至高幅θ波呈长程节律出现,散在大量δ波。应用24h脑电监护和视频脑电监测(VEEG)28例,能定侧定位者20例,阳性率为20/28(71.4%)。影像学检查:所有患者均行CT和(或)MRI检查,其中病灶位于额叶25例,顶叶2例,颞叶11例,枕叶1例,岛叶1例,额颞叶3例,额顶叶3例。其余7例为阴性,无器质性病灶。影像学上主要表现为局限性低密度、囊肿、钙化、占位性病变、海马硬化等。影像学上的病灶与脑电图上的致病灶基本一致者23例;脑电图上有局灶性放电而影像学上无异常者9例;脑电图上无局灶性放电而影像学上有局灶性异常者5例;脑电图与影像学定位不一致者1例。
1.3 手术方法 33例术中均行ECoG和深部电极或皮层电极监测。致痫灶切除后,再行ECoG和深部电极或皮层电极检查,确认无异常放电后才结束手术(见图1、图2)。本组单纯致痫灶切除术19例;致痫灶+多处软膜下横纤维切断术(MST)10例;胼胝体切开术6例;颞前叶切除术3例;海马、杏仁核切除术3 例;立体定向双杏仁核+Forel H区毁损术9 例;立体定向γ刀3 例。
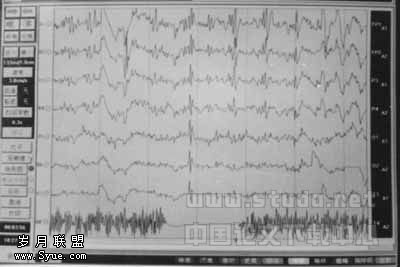
图1 术中ECoG发现的痫样放电
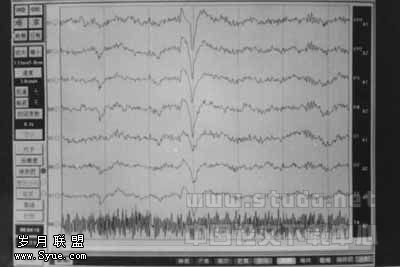
图2 术中切除致痫灶后ECoG示痫样放电消失
1.4 病理检查 蛛网膜囊肿7例;退行性变4例;胶质增生5例;结节性硬化1例;脑脓肿1例;胶质瘤14例;AVM 2例;猪囊虫1例。
1.5 统计学方法 单因素对疗效的影响用Ridit 分析,多因素对疗效的影响用Multinomial Logistic 回归模型似然比检验。
2 结果
见表1~表5。本组所有病例术后均得到门诊或通讯随访1~6年。术后结果按国际抗癫痫联盟疗效评定标准分为5类:(1)满意:癫痫发作完全消失(100%),除外术后早期几次癫痫发作,或每年偶尔有1~2次发作;(2)显著改善:癫痫发作减少>75%;(3)良好:癫痫发作减少>50%;(4)效差:癫痫发作减少25%~50%;(5)无改善。见表1~5。发作类型、病理类型及术前脑电图背景与疗效之间无明显相关性。
表1 手术方式与疗效之间的关系 (例)
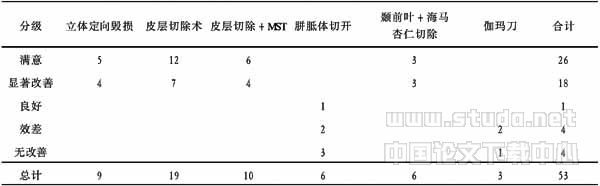
注:Ridit分析:χ2=23.3104>χ20.005(5)=16.75,P<0.005
表2 术后疗效与发病年龄的关系 (例)
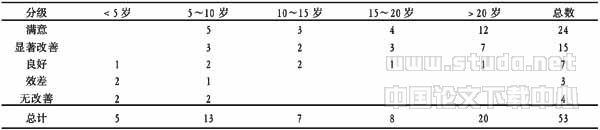
注:Ridit分析:χ2=14.0589 >χ20.01(4)=13.28,P<0.01
表3 术后疗效与总智商的关系 (例)
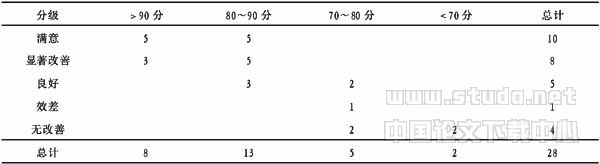
注:Ridit分析:χ2=15.6684 >χ20.001(3)=12.84,P<0.001
表4 术后疗效与术前发作次数的关系 (例)
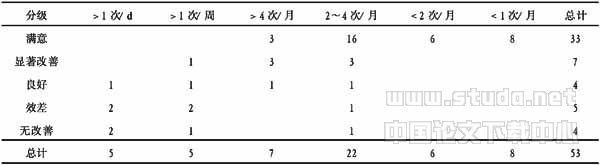
注:Ridit分析:χ2=15.4387 > χ20.01(5)=15.09,P<0.01
表5 Multinomial Logistic 回归模型似然比检验
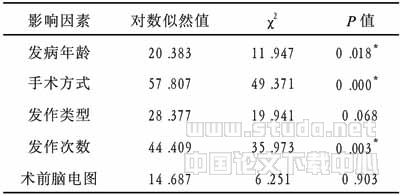
注:*P<0.05
3 讨论
癫痫是一种严重危害人类身心健康的中枢神经系统疾病,其临床患病率在5‰左右,其中20%左右的患者单纯服用AEDs难以控制癫痫发作,常需要进行手术[1]。手术的目的就是要切除原发癫痫放电细胞,阻断癫痫暴发活动的传播环路或投射束,或调整激发癫痫放电神经元的突触活动性或其扩散性,提高脑局部抗痫能力,以抑制或破坏已形成的癫痫体系,此体系包括产生异常放电的癫痫灶、传导这种电活动的扩散途径,以及能产生抑制的结构。按手术原理,治疗方式可分为以下几种:(1)通过切除脑部致痫灶达到控制或改善癫痫的目的。适合癫痫灶位于大脑皮层的运动或感觉型局限性癫痫、颞叶癫痫与婴儿脑性瘫痪3种。所采用的手术方法分别为大脑皮层癫痫灶切除术、颞叶切除术与大脑半球皮层切除术;(2)利用立体定向手术破坏癫痫灶或癫痫冲动的传导通路。用于治疗多种类型的癫痫,包括原发性癫痫中的大发作、小发作和婴儿痉挛与颞叶癫痫,所选择的靶点有:海马、杏仁核、Forel-H区、苍白球、豆状核、壳核、胼胝体、穹隆等结构;(3)大脑联合切断术,切断两侧大脑半球联合纤维,以阻断一侧半球的癫痫放电向另一侧半球传导,从而控制癫痫发作。适合于有继发性全身性发作或多病灶的发作或不能切除的单一病灶。对控制失张力(运动不能)发作、强直发作、强直-阵挛性发作效果最好;(4)电刺激小脑的表面,调整中枢的主动抑制来达到控制癫痫发作的目的,适合于各种发作类型的癫痫;(5)降低脑的局部温度,抑制痫灶放电。
一般认为患者经系统的AEDs治疗2年以上,每月仍有4次以上发作者便视为药物难治性癫痫[2]。外科手术治疗癫痫有3个重要的先决条件:(1)癫痫必须是药物难治性的;(2)手术必须具有可行性,即致痫灶能被确认并能安全切除;(3)对患者的癫痫发作和功能状态必须有满意的结果。目前较公认的外科治疗适应证包括[3]:(1)药物难治性癫痫:患者经大剂量、单一或多种AEDs药物联合,或加辅助药物系统治疗2年以上,且在血药浓度监测下用药,仍不能控制癫痫发作者;(2)部分性癫痫:多为继发,常有局限性的致痫灶,切除后癫痫发作可减少或消失;(3)可以切除的脑病理性病变:如肿瘤、血管畸形或其它的病变等;(4)提倡早期手术:一般在青春期后,药物难治2年以上,就可以考虑手术;(5)患者无精神病、进行性疾病或手术禁忌证;(6)服药虽然有效,但出现严重毒副作用,患者不能耐受者。手术禁忌证或相对禁忌证:(1)年龄过小(5岁以下),发作类型未固定者;(2)有严重的心肺功能异常,年老体弱不能耐受手术者;(3)患者存在严重智能缺陷,总智商在60分以下者[3]。本组53例手术均符合以上标准。
外科治疗的成功与否主要取决于致痫灶的定位准确性。笔者主要是根据临床发病特点、电生理检查和影像学检查等三个方面来确定,若三者阳性结果和定位信息完全一致,则致痫灶术前定位成立,如其中两者相一致,则定位基本成立,其中又以电生理检查最为主要。术前致痫灶的定位,对确定手术方案和选择手术切口至关重要,但能否准确的手术切除病灶,笔者认为术中皮层电极和(或)深部电极监测,可准确测定致痫灶的部位和范围,是手术取舍的抉择依据。皮层电图(ECoG)在癫痫外科手术中至关重要[4]:(1)定位致痫灶;(2)勾画皮层功能;(3)预测手术成功。一般将条状皮层电极放在切口范围内的脑皮层上反复移动检查,监测范围尽可能扩大,以便区别并找出原发放电灶和继发放电区的确切部位和范围。手术在尽可能小的损伤下准确地切除致痫灶和相应病灶。本组45例实行皮层和(或)深部电极监测。手术切除致痫灶后ECoG上痫波完全消失者41例,明显减少者4例。
癫痫的外科治疗方式很多,按手术原理大致可归纳为4大类:(1)要切除癫痫病灶为主的手术,包括脑皮质痫灶切除术、颞前叶切除术、选择性杏仁核、海马切除术、大脑半球切除术等;(2)以阻断癫痫放电扩散途径的手术,包括胼胝体切开、MST;(3)以毁损某些致痫区或传播通路的手术,包括立体定向射频毁损术、立体定向放射外科(γ-刀、X-刀);(4)以增强脑内抑制癫痫的功能,使大脑皮层的兴奋性降低的手术,如慢性小脑刺激术和迷走神经刺激术。对影像学检查所见的额叶、顶叶、枕叶等皮层病灶,电生理检查和临床发作特点相一致者,采用皮层致痫灶切除术,是最佳指征。手术疗效较为肯定,见表1及Multinomial Logistic 回归模型似然比检验。手术方式的选择主要依据癫痫患者的临床类型以及致痫灶的部位,一般认为一侧偏瘫伴顽固性癫痫,影像学上证实一侧半球有器质性疾病,如脑肿瘤、脑萎缩,EEG上证实一侧半球出现痫波或双侧半球均有,但以一侧偏胜,WADA实验证实语言中枢不在病侧半球者,可行大脑半球切除术[5,6];颞叶癫痫不管有无影像学阳性发现以颞前叶切除+海马、杏仁切除术为佳;致痫灶局限在颞叶外皮质非重要功能区者,做皮质切除效果最好;若致痫灶局限于皮质重要功能区而不能切除者,应行MST术,尽管该手术技术原理很简单,但需要操作熟练,以免损伤皮层柱和血液供应;而当致痫灶累及多脑叶或有多痫灶分布,在2个或2个以上脑叶或有双侧大脑半球广泛同步痫样放电而致原发痫灶定位困难时,则应行胼胝体切开术或立体定向Forel-H区毁损术,采用单一的手术方法很难达到满意的效果。如表1所示仅行胼胝体切开术的6例患者效果很差;本组所行立体定向毁损术9例、皮层切除术19例、皮层切除+MST 10例、颞前叶+海马杏仁切除术6例,均取得满意和显著改善的疗效;而行γ-刀治疗的3例患者效果不理想,可能与随访的时间太短有关[7],尚需进一步探讨。
从表2、表4可以看出(P<0.01),起病年龄越早,发作越频繁,术后疗效也就越差,结果与Multinomial Logistic 回归模型似然比检验一致。发病年龄越早,伴器质性脑病的可能性也就越大。如大田综合征的患儿,其器质性脑病的发生率在90%以上,West综合征在80%以上。而学龄前儿童出现的小发作和伴中央中颞棘波音,器质性脑病的伴发率在10%以下[7]。在原发病未得到彻底根治以前,其痫性发作亦很难得到控制。由于病灶区神经元频繁高幅放电,不断冲击异化其周围的神经元,使其膜电位稳定性下降,而异化为新的癫痫灶,这一点尤其是在大脑尚未完善的婴幼儿患者中表现更为明显。
脑电图反映了大脑的功能状态,任何一种疾病累及到大脑功能区均可出现脑电图的改变。癫痫患者的EEG异常可以表现为:(1)基本节律慢化;(2)α波泛化;(3)高幅β波[8]。EEG的背景异常越严重,说明该患者的大脑功能受损越严重,其预后也就更为不良。正常和轻度异常的患者病史短,发作次数少,对大脑皮层造成的损害轻而疗效好;而中度和重度异常者,因病史长,发作次数频繁,而且部分患者还出现过持续状态,痫性发作得不到控制,异常放电累及到广泛大脑皮层,手术难以切除整个致痫灶而造成效果差。长期大量服用AEDs也可能是另一个原因。但本组经Multinomial Logistic 回归模型似然比检验差异并无显著性,可能因为疗效是受多方面因素影响所致。
本组有28例如表3所示,手术前后进行了FIQ测量, 23例术后有不同程度的提高,无恶化者。说明术前FIQ正常或轻度降低者疗效明显好于FIQ中重度降低者。由于FIQ的高低基本上代表了整个大脑思维、想像、运算的能力,它的减低可以提示:(1)脑功能受损;(2)脑功能处于抑制状态。由于痫性发作长时间得不到有效控制,致痫灶范围不断扩大,以致影响到大脑广泛区域,加上大量AEDs的抑制作用,可使病史较长,发作较为频繁的癫痫患者智商降低,手术不能完全切除致痫灶,导致术后效果较差[8]。 Multinomial Logistic 回归模型似然比检验没能反映出FIQ与疗效的关系,可能的原因是病例数太少,有待于进一步探讨。
影像学发现的病灶,结合临床和脑电图的异常,三者一致时进行手术治疗,本组手术后的病理类型与术后疗效关系不大,因病例数太少,Multinomial Logistic 回归模型似然比检验没能反映出病理类型与疗效的关系。但胶质细胞瘤的疗效不太理想,可能与肿瘤边界不清,难以切除彻底有关。关于肿瘤合并癫痫的最佳治疗方法,目前仍有争论。不少学者认为单纯切除肿瘤,多数病例便可获得癫痫发作的控制。近年来,这一课题的专门研究报道不断出现,比较肯定的认为,肿瘤切除加致痫灶切除术后,可获得非常满意的癫痫控制,控制率达70%~95%[9]。本组低分级胶质瘤合并难治性癫痫14例,均行肿瘤切除加致痫灶切除,癫痫的控制率92.8%,与报道一致。
AEDs是癫痫患者控制或减少癫痫发作的主要手段,约有20%的患者成为药物难治性癫痫需行手术治疗[2],但是手术前后仍需服用AEDs。对于手术预后较好的颞叶癫痫,术前患者应先经至少两种药物治疗3年以上。手术后无一例外都要继续应用AEDs,只是用药剂量上的调整,如从多种药物改为单一药物,如患者至少2年不发作,可以考虑停药。也有学者报道术前78%的患者应用多种药物,术后降为14%,而停药的为44%[10]。本组患者除占位性病变外,其余均遵循以上原则,2年后停药者32例。总之,手术效果越差的癫痫类型,术后继续用药的时间也就越长。
癫痫的治疗是一个医学难题,需要综合治疗,随着医学的,如人类基因图谱的破译和神经干细胞移植的成功,对该病的治疗一定有新的突破。
【文献】
1 Viteri C,Iriarte J,Schlumberger E,et al.Surgical treatment of epilepsies:criteria for the selection of patients and results.Revista de Neurologia,2000,Suppl 1:s141-153.
2 Wieser HG,Burcet J,Russi A.Indications of the surgical treatment of epilepsy.Revista de Neurologia,2000,30(12):1190-1196.
3 谭启富,李龄,常义,等.癫痫外科学.南京:南京大学出版社,1995,292-293.
4 Laxier KD,Garcia PA.Imaging criteria to identify the epileptic focus: MRI,MRS,PET,SPECT.Neurosurgery Clinics of North America,1993,4:199.
5 Smith MC.Multiple subpial transection in patients with extratemporal epilepsy.Epilepsia.1998,39(suppl 4):s81-89.
6 Engel J.Surgical treatment of the epilepsies.2nd edition.NewYork:RavenPress,1993,23-25.
7 Regis J,Bartolomei F,Hayashi M.et al.The role of gamma knife surgery in the treatment of severe epilepsyies.Epileptic Disorders,2000,2(2):113-122.
8 Issam A,Awad.Intractable Epilepsy and structural lesions of brain.mapping resection strategies and seizure outcome.Epilepsia,1991,32(2):179.
9 Khajavi K,Comair YG,Wyllie E,et al.Surgical management of pediatric tumor-associated epilepsy.Journal of Child Neurology,1999,14(1):15-25.
10 Mclachlan RS,Maher J.Management of antiepileptic drugs following epilepsy surgery:a review.Canadian Journal of Neurological Sciences,2000,27 (suppl 1):s106-110,s121-125.











