阿尔茨海默病防治研究的现状与展望
【关键词】 阿尔茨海默病;淀粉样蛋白;β分泌酶
摘要:阿尔茨海默病(AD)是一种严重的中枢神经系统退行性疾病。本研究室十多年来对该病的发病机制,特别是在防治方面进行了一些实验研究工作,并结合国内外最新的研究成果,提出了AD新的理念和策略,为该病未来的临床治疗研究提供了新的思路。
关键词:阿尔茨海默病;淀粉样蛋白;β分泌酶
KEY WORDS: Alzheimers disease; Amyloid peptide; βsecretase
阿尔茨海默病(Alzheimers disease, AD)是一种严重的中枢神经系统退行性疾病,严重损害患者的认知功能,造成生活自理能力的障碍和精神行为的异常。AD患者脑的典型病理特征为:老年斑的形成、神经原纤维缠结和神经细胞的大量死亡。统计结果显示,65 岁以上老人中有约10%,85 岁以上老人中有50%患有该病。因此,不应把AD 看作是正常的衰老过程,它是一种进行性、不能治愈的神经系统退行性疾病[1]。目前,AD 的病因学和发病机制尚不清楚。根据其病理生理特点,很多方法可改善AD 患者的记忆和认知功能,阻止或延缓发病及疾病进展。通过近几年的研究发现,很多因素在AD的发病过程中起着至关重要的作用,特别是对淀粉样蛋白形成、沉积和毒性的研究,蛋白水平和基因水平抑制剂的研究,免疫疗法以及中医传统药物、神经营养素的使用等等,使AD的治疗前景出现一线曙光。
1 β淀粉样蛋白的研究
Aβ是一种含有39-42个氨基酸的多肽,其分子质量为4ku,又称Aβ4,是β淀粉样前体蛋白(βamyloid protein precursor, APP)跨膜分泌的产物。Aβ在脑中的纤维沉积是AD患者的主要病理变化,它在AD发生中起着非常重要的作用,其神经毒性已被证实。近年来,大量研究表明,Aβ的毒性机制与氧自由基引起的氧化应激、细胞内钙稳态失调,以及由此引起的细胞凋亡有关[2]。 APP基因位于21号染色体上,含有19个外显子,是一种广泛存在于全身组织细胞膜上的跨膜蛋白。研究表明,正常体内APP多经过α分泌酶和γ分泌酶的作用,即存在于膜表面的α分泌酶在Aβ结构内(赖氨酸16和亮氨酸17之间)切割APP,产生各含部分Aβ片断的分泌型APP和C端片断(P3CT)。这一过程破坏Aβ的完整结构,产生的可溶性片断容易被消除,该途径称为非淀粉样蛋白途径。正常生理状态下,该代谢途径占优势。若经β分泌酶和γ分泌酶作用,则分别在Aβ的N和C末端切割APP,由β分泌酶从Aβ区的N端分泌产生含有膜的C端,成为γ分泌酶的底物,然后γ分泌酶在细胞内引起Aβ的生理分泌,该过程称为淀粉样蛋白生成途径[3]。生成的Aβ其中约90%为Aβ40,其余大部分为Aβ42。Aβ42含有42个氨基酸,在老年斑的形成中可能起着重要的作用;Aβ40在C端少了两个氨基酸,存在于AD患者和正常人群中,它可能是细胞代谢的非病理性产物。由于Aβ在AD发病中的作用至关重要,因此减少Aβ的产生,加快其消除,阻止Aβ聚集和形成有毒性的淀粉样蛋白,对抗Aβ的毒性和抑制它所引起的免疫炎症反应都可以成为AD 治疗的策略。
2 针对Aβ产生的相关因素的研究
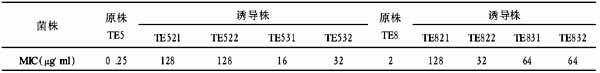
减少Aβ的产生,第一条途径是激动α分泌酶。现在已找到两个候选的α分泌酶,分别为肿瘤坏死因子α转化酶(tumor necrosis factorα converting enzyme, TACE) 和解整联蛋白金属蛋白酶10(a disintergrin and metalloprotease 10, ADAM10) 。它们均属于ADAM家族。TACE 作用于TNFα前体蛋白,释放其胞外区域,生成TNFα[4]。进一步的研究表明α分泌酶激动剂是一个减少Aβ的间接途径,它引起神经递质受体激动所带来的对机体的影响远远大于其对APP 代谢的影响。第二条途径是抑制产生Aβ的关键限速酶β分泌酶的活性。β分泌酶是一个新型的膜结合天冬氨酸蛋白酶,由501个氨基酸残基组成,它的基因定位于11 号染色体上(11q 2313) ,这是一个与AD 不相邻的基因座。其mRNA在人体各种组织中都有表达,在胰腺和大脑各个亚区内表达量最高,AD患者脑中有Aβ沉积的前额皮层中β分泌酶的表达量是无Aβ沉积的小脑内的3倍。在神经元中β分泌酶活性较高。为了证实抑制β分泌酶不会对正常组织和细胞产生毒害作用,几个研究小组进行了β分泌酶基因剔除实验[5],研究表明,这些基因缺失的小鼠生长正常,对形态学、组织学、解剖学、血液学以及动物行为等分析结果显示它们与正常小鼠无显著差异,但基因缺失小鼠的脑和培养的神经细胞中β分泌酶活性消失。用β分泌酶基因缺失小鼠与Swedish APP 过表达的转基因小鼠交配产生的第二代小鼠中也没有过量的Aβ。用表达APP 的腺病毒感染缺失β分泌酶的神经细胞,通过质谱和凝胶电泳分析显示不产生Aβ。体外分析还发现,在β分泌酶缺失小鼠的脑及培养的神经细胞抽提液中检测不到Aβ及β分泌酶活性。这些实验证实了抑制β分泌酶的活性在体内不会引起高毒性。这就为抑制β分泌酶试验提供了实验基础。
3 蛋白水平和基因水平抑制剂的研究和开发
虽然β分泌酶已被普遍认为是治疗AD 的药物靶点之一,但报道的相关抑制剂却非常有限,β分泌酶虽然是胃蛋白酶类,但却可以抵抗胃蛋白酶抑制剂的作用,如天冬氨酸蛋白酶的广谱抑制剂抑胃肽A(胃蛋白酶抑制剂) 在30-50μmol/L的浓度范围内并不能封闭其活性。目前的抑制剂主要是针对瑞典突变型 APP 酶切位点附近氨基酸序列设计的过渡态类似物抑制剂。因此,探索新型的β分泌酶抑制剂显得尤为重要。随着分子生物学理论和技术的逐步发展和完善,RNA干扰(RNA interference, RNAi)越来越受到人们的重视。RNA干扰是1998 年首次在秀丽线虫中发现并证明属于转录后水平的基因沉默机制[6]。利用双链RNA可以特异性地降解相应序列的mRNA,从而特异性地阻断相应基因的表达。随后的研究表明,RNA干涉广泛存在于从真菌到植物、从无脊椎动物到哺乳动物的各种生物中。 Kao[7] 以原代培养的皮质海马神经元为实验对象, 将化学合成的针对β分泌酶的短干扰RNA(short interference RNA, siRNA) 转染到小鼠神经元内干扰内源β分泌酶基因的表达。结果表明,β分泌酶基因表达显著降低,Aβ生成下降。同时还发现,β分泌酶基因表达被抑制之后APP及早老素1 (presenilin 1, PS1 ) 在亚细胞内的分布并没有改变,并且也无明显增加。提示利用siRNA 抑制β分泌酶不会导致细胞的重大缺陷。2005年,Singer[8]发现以APP 转基因小鼠为动物模型,构建针对BACE的siRNA 的慢病毒表达载体,并将表达载体注射到转基因鼠的海马内,随后对转基因鼠海马组织进行了一系列淀粉样蛋白含量和BACE蛋白水平的检测。结果表明, 实验组转基因小鼠海马组织内BACE水平显著下降,淀粉样蛋白生成降低,同时实验组小鼠的行为学缺陷也得到了一定改善。这使得基因干扰技术首次用于动物模型抑制分泌酶的表达。说明了基因干扰技术用于动物实验的可行性。它标志着RNA干扰技术治疗阿尔茨海默病成为可能。本研究室利用分子生物学的方法,成功构建了针对Aβ 产生的关键限速酶β分泌酶的特异性短干扰RNA 真核表达载体pLXSN/EGFPU6siBACE,并包装成逆转录病毒,感染转入β分泌酶基因的人神经母细胞瘤细胞株SKNSH ,观察到了siRNA 明显抑制β分泌酶蛋白的表达。该方法方便易行,产物不易降解而且抑制效率较高[910],为利用RNA干扰技术治疗AD提供了一定的研究基础。由于在AD患者脑内,β分泌酶含量及活性增高,Aβ的产量异常增加,因此减少β分泌酶酶切APP 成为降低Aβ产生的另外一个关键步骤。最新研究发现,合成β分泌酶酶切底物抑制肽(NH2ThrAsnIleLysThrGluGluIleSerGluValAsnLeuValAlaGluPheArg)可以很有效地竞争性结合β分泌酶,从而减少该酶对APP的酶切,即减少了Aβ的产生,为治疗AD带来新的尝试[11]。但是,这种底物肽本身不易进入细胞内,而且容易降解,如何使其进入细胞内并持续表达成为该研究的难点。本研究室已经通过PCR的方法,克隆出β分泌酶底物肽基因,应用逆转录病毒介导将目的基因整合到SKNSH细胞的基因组中,使该基因可以随细胞的增殖,稳定且长效地表达,避免了需长期、外源给药的不便。以重组病毒感染靶细胞,使该抑制剂与APP竞争性结合β分泌酶,可明显降低由Aβ 引起的细胞死亡率,提示分泌酶抑制剂对由APP诱导的AD模型细胞具有预防性保护作用。在AD的实验研究过程中,靶细胞的选择非常重要。目前的AD细胞模型主要是由以下6大类细胞诱导建立:神经细胞、神经嵴源细胞、神经胶质细胞、非神经细胞、基因工程细胞、杂交组织细胞。其中,基因工程细胞株主要有:COS1、CV1、PC12、SKNSH和A172细胞株,特别是后三种,不仅具有神经元的特性,还因可表现AD的细胞特性而用于进行有关AD的研究,但其缺点是技术难度较大,费用较高。现今,国内外采用最多的AD模型细胞为PC12、原代培养的海马和大脑皮质神经细胞,其次为基因工程细胞。本实验室所采用的AD细胞模型是神经母细胞瘤细胞,该细胞株为神经系统的肿瘤细胞,带有多种神经元的标记,神经元特性明显。但是,在做整体动物实验时,就遇到了病毒是否能感染正常细胞的问题。一般来说,普通的逆转录病毒很难感染正常神经元,而且病毒的安全性也受到一些质疑。本研究室正在构建慢病毒载体。慢病毒载体不但能感染肿瘤细胞,对正常细胞也有很高的感染率。因此,成为动物实验中外源基因进入的最为理想的感染工具。
4 抗β淀粉样蛋白的免疫治疗
Aβ免疫疗法是目前最新和最引人瞩目的方法之一,旨在延缓或清除脑组织中的Aβ集聚。1997年以色列Solomon等[12]报道,抗Aβ抗体在体外可抑制Aβ的聚集和纤维形成。他们用显微镜观察负染的Aβ与其抗体的免疫复合物,发现即使在肽和抗体比率很低的情况下,抗体也可诱导Aβ从纤维状向非纤维状转化。后来Bard等[13]研究发现,用抗Aβ抗体作被动免疫,亦可达到预防和清除AD转基因小鼠脑内老年斑的目的。目前,国内外研究AD主动免疫所用的免疫原,大多采用直接化学合成Aβ全长或部分片段[14] 。这种方法具有一定的局限性和不足:技术设备要求较高、成本昂贵,而且有报道转基因模型鼠对合成的Aβ多肽的免疫反应较弱[15], 使之推广和研究受到了很大限制。在国外,Aβ的主动免疫治疗,已完成I 期临床试验,近一半接受Aβ免疫治疗的受试者产生了抗体。研究表明,抗体的产生与Aβ剂量和免疫时间有关。本实验室通过基因工程的方法将Aβ基因插入HBcAg基因的中间部位(编码72-87氨基酸区),并使其在大肠杆菌中表达融合蛋白cAβc。结果显示,融合基因能在大肠杆菌中表达,表达的融合蛋白主要以包涵体的形式存在于细菌裂解物的沉淀中,表达量为细菌沉淀总量的16%。以融合蛋白cAβc免疫BALB/C小鼠3次,小鼠血清中抗Aβ抗体的效价可达1∶16000,而且由于删除了HBcAg的c/e1表位,在小鼠血清中未检测到抗HBc抗体。本结果为进一步进行的动物和临床实验奠定了基础 [1617]。随后将融合蛋白cAβc免疫的小鼠血清,以不同浓度与Aβ在37℃下共同孵育,观察其对Aβ聚集和纤维化的作用。结果显示,血清浓度从1∶2000开始,就表现出抑制聚集和纤维形成的功效,且随着浓度加大,抑制效果愈加明显。到1∶500时,完全抑制了Aβ的聚集。根据我们的实验结果和相关报道,并非所有的抗Aβ抗体均可预防和治疗AD,仅针对氨基端的抗体才有抗Aβ聚集的作用。因而以上结果表明,融合蛋白cAβc免疫后所产生的血清在体外具有抑制Aβ聚集和纤维化的作用。此外,我们发现,高滴度的免疫血清可对抗Aβ对神经母细胞瘤细胞的毒性作用;通过融合蛋白cAβc免疫SD大鼠。可减轻其脑内Aβ的病理改变[18]。Bard 等[13] 通过大量实验证实了通过外周注射Aβ42 抗体给PDAPP 转基因鼠后,抗体可以进入中枢神经系统,使脑内Aβ量下降,并通过Fc受体介导的吞噬作用引起老年斑的降解,从而提示抗体可以通过血脑屏障,为AD的治疗带来一线曙光。Chauhan等[19] 提出在10月龄的Tg2576 鼠脑室内注射Aβ抗体,可以减少老年斑,并能减少老年斑周围IL1β阳性的小胶质细胞的数量,认为脑室内被动免疫尽管是侵入性的, 但较主动免疫更安全。由此看来,两种免疫方式各有其优缺点。主动免疫可以引起脑内微出血和脑膜炎。但是,由于被动免疫治疗需反复注射抗体,治疗费用昂贵,制约了临床应用;尤其是制备的单克隆抗体属于异源蛋白,其可能出现的过敏反应也不适于反复应用。因此,AD的免疫治疗仍然有待于更多的实验研究。
5 AD的其他相关研究
神经生长因子(nerve growth factor, NGF)、胶质细胞源性神经营养因子(glia cell linederived neurotrophic factor, GDNF)及脑源性神经营养因子(brain derived neurotrophic factor, BDNF)等是一类比较有前途的药物。大量体内、外研究显示,它们不仅对胚胎神经元的发生、发育和存活具有调节作用,而且对发育完全成熟的神经元正常功能的维持、各种脑损伤后神经元的修复以及挽救中枢神经退行性变中神经元的死亡有重要作用。本研究室利用分子生物学技术构建并制备了BDNF的重组腺伴随病毒载体[20],探讨了重组人脑源性神经营养因子(rhBDNF)对正常原代培养海马神经元及Alzheimer 病模型海马神经元的作用,研究发现,rhBDNF对正常培养海马神经元有营养作用,能延长细胞生存时间;对AD模型海马神经元有保护作用,显著降低了细胞死亡率,抑制了Aβ对神经元的毒性,有助于AD的防治[21]。但是,由于各种神经营养因子价格昂贵,外周给予不能通过血脑屏障,脑内直接给予较困难。寻求安全输送入脑内的方法非常重要;另外,由于神经营养因子分子量大,不能透过血脑屏障,长期脑室内治疗存在很多技术问题等都限制了它们的临床应用。因此,探讨如何通过其他手段,如构建慢病毒载体,将外源基因直接导入体内脑组织,使之进入神经细胞并进行表达,或者脑内移植能产生BDNF的基因工程细胞等都将是我们进一步研究的工作重点。众所周知,神经干细胞(neural stem cell, NSC) 的基本特性是具有自我更新和多分化潜能,因而被认为是中枢神经系统损伤后再生修复的理想材料和基因载体。NSC移植可以改善AD模型大鼠的学习和记忆能力,提示移植的NSC的确可以替代海马内丢失、受损的神经元并且恢复(或部分恢复)其功能。NSC用于AD的治疗,可能具有广泛的应用前景[22]。NSC移植不仅可以修复补充神经元缺失,还可修复全脑性的神经胶质损伤,自身NSC大量增殖后的移植可解决棘手的免疫排斥反应,所以NSC移植对AD和其他脑损伤与脑退行性疾病有重要意义。实验已证明BDNF对神经元的生长、分化及损伤后修复有促进作用[23],具有治疗如阿尔茨海默病等一些中枢神经系统退行性疾病的潜力[ 2425]。但是,很多实验表明给予外源性神经营养因子的疗效不佳,须借助载体或移植的方法才能使其到达作用部位。神经营养因子与NC增殖、分化关系密切,神经营养因子对NSC分化到终末细胞的整个过程均有影响[2627]。考虑到神经干细胞和BDNF对神经系统病变的特殊作用,本研究室分别观察了单纯NSC移植和人BDNF(human BDNF, hBDNF)基因修饰的NSC移植对AD模型大鼠学习记忆改善的效果,结果表明,脑内移植NSC和hBDNFNSC可以显著提高AD模型大鼠的空间学习记忆能力且效果明显,一方面提高脑内BDNF的含量,加强对神经元的营养作用,有利于AD的治疗;另一方面又有利于干细胞向神经元分化,补充丢失的神经元,可能优化治疗效果。该研究为神经干细胞结合神经营养因子共同治疗AD的研究奠定了重要而扎实的实验基础[28]。中医学认为AD是一种全身性疾病,古代虽无此名,但其证候则散见于“文痴”、“善忘”、“郁证”、“呆病”等病证中。临床治疗常用药物为菖蒲、黄芪、当归、地黄、枸杞、远志、益智仁、丹参、菟丝子、山萸和川芎等。其中菖蒲、远志化痰降浊、安神定志; 枸杞、山萸、益智仁、菟丝子补肾健脑、养精益智; 黄芪益气养血补脑; 丹参、川芎活血化瘀通络;地黄、当归滋肾强精、养肝益血。中药主要从改善神经递质代谢紊乱、抑制神经元细胞凋亡、减轻Aβ沉积和tau 蛋白异常磷酸化等方面对机体进行调节,从而发挥其对AD的治疗作用。在对传统中医药治疗AD文献的阅读当中,我们首次采用川续断总皂甙进行AD模型的研究,并与维生素E 进行比较来观察二者对AD大鼠背海马结构神经元内Aβ表达的影响[29]。结果显示,在川续断总皂甙和维生素E处理1个月后在AD大鼠海马结构内的AβL I神经元的数量、截面积和吸光度都有减少和降低,同时随治疗时间的延长这种变化更加明显。提示川续断总皂甙可能具有与维生素E相似的抗AD作用;推测川续断总皂甙和维生素E对AD模型大鼠的治疗作用机制可能是通过抑制和清除Aβ过度表达而实现的。所以川续断(或者它的有效成分总皂甙) 有希望成为治疗AD和抗衰老的新药。另外,采用原代神经细胞培养技术研究发现,以Aβ25-35 诱导建立AD的细胞模型,用人参总皂甙(TSG) 作阳性对照,观察了天麻素对Aβ25-35 诱导大脑皮层、海马神经元损伤的保护性影响[30]。研究结果显示,不同质量浓度的天麻素对Aβ25-35诱导的神经损伤亦有较强的保护作用,可显著降低神经细胞的死亡率,结果显示天麻素具有明显的神经细胞保护作用,为天麻素在AD上应用的进一步研究提供实验依据。
6 问题与展望
目前,淀粉样级联学说受到了越来越多的研究人员的重视,针对Aβ的产生、聚集、增加降解、减少对神经元的毒性方面的研究都取得了令人鼓舞的结果。但是,AD的病因非常复杂,多因、异质是其病因学的基本特点。因遗传因素造成的AD患者仅占少数,而且老年斑的沉积也并不是AD患者唯一的病理变化。因此,其他因素的作用也不容忽视。其次,在细胞水平观察到的实验结果,是否能在整体动物上有同样的效果,以及利用外源基因导入的技术,如RNAi,反义寡核苷酸技术在整体动物实验中会不会出现畸形等问题也值得重视,病毒转染的安全性和可靠性等等问题的出现,也为进行整体动物实验带来诸多困难。第三,AD模型细胞和模型动物的选择也是影响实验结果的重要环节。目前,还没有非常理想的AD模型可以模拟AD患者所有的病理变化。本研究室使用原代培养的神经元和神经母细胞瘤细胞株作了较多的尝试,取得一定效果,但是也发现了不少问题。由此看来,AD的防治研究任重道远,寻求有效、安全的治疗AD的方法将促使我们在阿尔茨海默病这一困扰人类多年的顽疾上面作出不懈的努力和探索。
文献:
[1]陈彪,马秋兰. 阿尔茨海默病病因学研究进展及治疗展望 [J] .中华神经科杂志, 2003, 36(2):158.
[2]Huang HM, Ou HC, Hsieh SJ, et al. Antioxidants prevent amyloid peptideinduced apoptosis and alteration of calcium homeostasis in cultured cortical neurons [J]. Life Sci, 2000, 66(19):18791892.
[3]Yan R, Bienkowski MJ, Shuck ME, et al. Membraneanchored aspartyl protease with Alzheimers disease betasecretase activity [J]. Nature, 1999, 402(6761):533537.
[4]Buxbaum JD, Liu KN, Luo Y. Evidence that tumor necrosis factor alpha converting enzyme is involved in regulated alphasecretase cleavage of the Alzheimer amyloid protein precursor [J]. J Biol Chem, 1998, 273(43):2776527767.
[5]Roberds SL, Anderson J, Basi G, et al. BACE knockdown mice are healthy despite lacking the primary betasecretase activity in brain: implications for Alzheimers disease therapeutics [J]. Hum Mol Genet, 2001,10:13171324.
[6]Hannon GJ. RNA interference [J]. Nature, 2002, 418(6894): 244251.
[7]Kao SC, Krichevsky AM, Kosik KS, et al. BACE1 suppression by RNA interference in primary cortical neurons [J]. Bio Chem, 2004,279(3):19421949.
[8]Singer O, Marr RA, Rockenstein E, et al. Targeting BACE1 with siRNAs ameliorates Alzheimer disease neuropathology in a transgenic model [J]. Nat Neurosci, 2005,8(10):13431349.
[9]董炜疆,胡海涛,冯改丰.β淀粉样前体蛋白裂解酶特异性小干扰RNA真核表达载体的构建和鉴定 [J]. 西安大学学报(医学版), 2004, 26(5):413417.
[10]胡海涛,董炜疆,冯改丰,等. 短干扰RNA特异性抑制哺乳动物β淀粉样前体蛋白裂解酶基因表达 [J].浙江大学学报(医学版), 2006, 35(6):622629.
[11]Jay S, David L, John P, et al. Design of subtratebased inhibitors of human β secretase [J]. Med Chem, 2002,45(2):259262.
[12]Solomon B, Koppel R, Franke lD, et al. Disaggregation of Alzheimer betaamyloid by site directed mAb [J]. Proc Natl Acad Sci USA, 1997, 94(8):41094112.
[13]Bard F, Cannon C, Barbour R, et al. Peripherally administered antibodies against amyloid beta peptide enter the central nervous system and reduce pathology in a mouse model of Alzheimer disease [J]. Nat Med, 2000,6(8):916919.
[14] 胡金家, 汪华侨, 曲怀刚, 等. Aβ42及亚单位疫苗诱导小鼠抗体产生及其中和Aβ42的细胞毒性 [J]. 细胞与分子免疫学杂志, 2004,20(2):178181.
[15]Alon M, Ruth M, Victor Z, et al. Immune hyporesponsiveness to amyloid β peptide in amyloid precursor protein transgenic mice: implications for the pathogenesis and treatment of Alzheimers disease [J]. Proc Natl Acad Sci USA, 2001, 98(18):1027310278.
[16] 冯改丰,胡海涛,李月英. 重组基因cAβc的构建及其表达蛋白的免疫原性分析 [J]. 细胞与分子免疫学杂志, 2005, 21(5):533537.
[17]胡海涛,冯改丰,董炜疆. 融合基因AβHBcAg的原核表达及表达蛋白的免疫反应性和免疫原性分析 [J]. 西安交通大学学报(医学版), 2004,25(3):220222.
[18]冯改丰,胡海涛,靳辉. 融合蛋白CAC免疫的小鼠血清可抑制β淀粉样肽的纤维形成 [J]. 老年学杂志, 2005,10:11871189.
[19]Chauhan NB, Siegel GJ. Intracerebroventricular passive immunization with antiAbeta antibody in Tg2576 [J]. J Neurosci Res, 2003, 74:142147.
[20]马东亮,胡海涛,王建明. 人脑源性神经营养因子重组腺伴随病毒的制备 [J]. 西安交通大学学报(医学版), 2003, 24(5):431437.
[21]刘朝晖,胡海涛,马东亮. 重组人BDNF 对Alzheimer 病模型神经元作用的实验研究 [J]. 西安交通大学学报( 医学版), 2003, 24(1):58.
[22]周辉,杨春,章茜,等. 神经干细胞移植对AD大鼠学习记忆能力的影响 [J]. 郑州大学学报(医学版), 2005, 40(4):663666.
[23]Ebadi M, Bashir RM, Heidrick ML, et al. Neurotrophins and their receptors in never injury and repair[J]. Neurochem Int, 1997, 30(425):347374.
[24]Gray JA, Grigoryan G, Virley D, et al. Conditionally immortalized multipotential and multifunctional neural stem cell lines as an approach to clinical transplantation [J]. Cell Transplant, 2000, 9(2):153168.
[25]李京凤, 朱晓峰. 神经干细胞在A lzheimer 病治疗中的应用 [J]. 黑龙江医药, 2003, 26(5):97100.
[26]朱晓峰, 张晓梅, 刘玉芳, 等. EGF、bFGF、BDNF 对大鼠海马神经干细胞增殖和分化的作用 [J]. 神经疾病与精神卫生, 2002, 2(6):389.
[27]Shetty AK, Turner DA. In vitro survival and differentiation of neurons derived from epidermal growth factor responsive postnatal hippocampus stem cells: inducing effects of brainderived neurotrophic factor [J]. J Neurobiol, 1998, 35 (4):395425.
[28]赵志英,胡海涛,冯改丰.人脑源性神经营养因子基因修饰神经干细胞移植对痴呆大鼠学习记忆的改善 [J]. 中国修复重建外科杂志,2005,19(5):331334.
[29]胡海涛,杨杰,钱亦华. 续断对Alzheimer 病模型大鼠海马结构淀粉样沉积的影响 [J]. 中国老年学杂志,1999,19:160161.
[30]刘中华,胡海涛,冯改丰. 天麻素对Aβ2535 诱导的Alzheimer 病细胞模型的保护作用 [J]. 四川大学学报(医学版), 2005, 36(4):537540.