氟尿嘧啶影响人大肠癌细胞增殖及凋亡的分子机制
作者:刘永年 王索安 赵明 张伟 赵海龙 李菊英
【摘要】 目的 研究氟尿嘧啶(5-Fluorouracial,5-FU)体外影响人大肠癌Lovo细胞增殖抑制及诱导凋亡的分子机制。方法 采用四甲基偶氮唑盐(MTT)显色法,检测不同浓度5-FU作用不同时间对Lovo细胞生长所产生的不同影响;光镜观察凋亡细胞的形态特点;流式细胞术( FCM)检测凋亡细胞百分率;琼脂凝胶电泳、免疫组化SP法检测 Lovo细胞增殖核抗原Ki-67及凋亡相关基因蛋白p53、Fas表达水平。结果 5-FU能抑制 Lovo细胞生长,在一定剂量和时间范围内,通过光镜观察,见凋亡细胞明显增多,经5-FU诱导后,用FCM分析Lovo细胞,发现凋亡百分率增加并显示剂量和时间效应。实验组细胞Ki-67表达明显低于对照组,Fas表达明显升高,而P53在诱导前后均无表达。结论 5-FU能诱导Lovo细胞凋亡并抑制其增殖及侵袭性,Fas基因激活可能是触发Lovo细胞凋亡的主要机制。
【关键词】 氟脲嘧啶 大肠癌 细胞凋亡 流式细胞术 琼脂凝胶电泳
A MOLECULAR MECHANISM FOR EFFECTS OF
Abstract Objective To study the molecular mechanism for 5-Fluorouracial(5-FU) and clarify whether it inhibit proliferation and induce apoptosis of colon cancer Lovo cells. Methods MTT Chromatography is adopted to test effects of 5-FU of different concentration and at different time of reaction over growth of Lovo cells; photomechanical method used to observe configuration and characteristics of apoptosis cells; FCM employed to test the percentage of apoptosis cells; electrophoresis and immunized grouping SP applied to test antigen Ki-67 of Lovo cells proliferation and expression of P53 and Fas genetic proteins in relation to apoptosis. Results 5-FU inhibits growth of Lovo cells; it is found that within a limited dosage and period of time, there has been an obvious increase in apoptosis cells under the photomechanical scope; the analysis of Lovo cells by FCM showed that after the induction of 5-FU, the percentage of apoptosis cells has increased; and FCM also displays dosage and time effects. Electrophoresis was obviously in a stripe shape of trapeziform. In the project group, Ki-67 expression in cells is clearly lower than that in the control group, and Fas expression in cells apparently tends to rise, whereas P53 has no expression before and after the induction. Conclusion 5-FU can induce apoptosis of Lovo cells and inhibit its proliferation and attack; activation of Fas gene might be the primary mechanism of triggering Lovo cells to apoptosis.
Key words 5-FU Colon cancer Cell apoptosis FCM Electrophoresis
5-Fu在众多大肠癌化疗药物中疗效最佳,故目前的化疗方案均以5-Fu为主,辅以其他化疗药物和一些生物增效剂[1] 。大量研究表明,5-Fu可通过诱导肿瘤细胞凋亡而抑制和杀伤肿瘤细胞,但5-Fu诱导肿瘤细胞凋亡的确切机制尚不完全清楚[2,3]。本实验通过观察5-Fu体外诱导Lovo细胞凋亡过程,探讨5-Fu体外诱导肿瘤细胞凋亡作用及其性;通过检测细胞增值指标Ki-67的表达,探讨细胞增殖与凋亡的相关关系。
1 材料与方法
1.1 细胞培养
1.1.1 材料:大肠癌Lovo细胞株购自南京八一全军肿瘤中心细胞室。培养液:RPMI-1640 [sigma公司产品。用前加双抗、青霉素(100U/mL)、链霉素(100μg/mL)]。小牛血清:杭州四季青生物工程公司产品。0.25%胰酶、0.02íTA、Hanks液、3.7%NaHCO3等试剂自配。CO2培养箱(NATURE,USA), 倒置相差显微镜(Olympus CKX,Japan)。
1.1.2 方法 :(1)细胞复苏:将冻存在离心管内的Lovo细胞用37℃水浴解冻。吸出细胞悬液,装入另一支离心管中,加入含15%小牛血清的1640培养液(pH7.2),吹打混匀后离心(1000r/min,5min),吸去冻存液。(2)细胞培养:复苏细胞加入含15%小牛血清的1640培养液充分混匀,使其浓度为5×104个/ mL,接种于培养瓶中。置孵箱(37 ℃,5% CO2)内培养。(3)细胞转代(倒置显微镜下观察):培养瓶内细胞长满单层后弃掉培养液。加入适量0.25%胰酶液(覆盖瓶底),置37 ℃环境中消化1~2 min。观察到细胞收缩并出现裂隙后终止胰酶反应。加入适量的Hanks液轻轻洗一遍后加入含15%小牛血清的1640液5 mL吹打制成细胞悬液,按5×104个/mL浓度接种培养。
1.2 细胞增殖抑制试验(MTT还原法)
1.2.1 材料:氟脲嘧啶(Fluorouracil),分子量130.08,使用前用培养基液稀释到所需浓度。噻唑蓝(MTT)为sigma公司产品,用无血清1640培养液配制(浓度5mg/mL),4 ℃避光保存。96孔培养板。自动酶标检测仪为DG3022A型。二甲基亚砜(DMSO)为国产分析纯。0.4%胎盼蓝溶液自配。
1.2. 2 方法:将对数期生长细胞用0.25%胰酶消化,使贴壁细胞脱离,用含15%小牛血清的1640培养液配成悬液。用胎盼蓝排除法测定细胞存活率(>97%)。用含15%小牛血清的1640液调整细胞悬液浓度为1.0×105个/ mL。接种细胞于96孔培养板中,每孔100μL,5%CO2温箱中培养,24 h后换液。实验组细胞加100μL终浓度达40 、80、160 mol/L的完全培养基,阴性对照组细胞加100 μL完全培养基,空白对照孔仅含100μL完全培养基,不含细胞,每浓度时间组设6复孔。分别继续培养24、48、72h。每孔加入5mg/mLMTT溶液25μL,37 ℃温育4 h,使MTT还原为甲臜。吸出上清液加入150μL DMSO(二甲基亚砜)使甲臜溶解,轻微振荡摇匀。在上述条件下,用自动酶标仪在波长570 nm处测定每个小孔的光度值(OD值)。杀伤率公式为杀伤率=(1-试验组OD值)×100%/对照组OD值。
1.3 光镜下细胞形态的观察
1.3.1 培养瓶中细胞形态观察:培养瓶中接种1×106个细胞,培养24 h,生长良好者,用不同浓度(10、40、80、160μmol/L)5-Fu分别处理24、48、72 h,每12 h用倒置显微镜观察并照相记录用药组和对照组细胞的形态变化。
1.3.2 细胞爬片和HE染色下细胞形态的观察:用6孔培养板接种1×106个细胞,培养24 h,生长良好,不同浓度不同时间各组分做6个复孔,其余处理同“1.3.1”所示方法。
1 .4 流式细胞术检测
1.4.1 材料:碘化丙啶(PI)为Sigma公司产品。流式细胞仪为美国B.D公司产品。
1.4.2 方法:收集实验组和对照组细胞各约1×106个,用PBS洗涤后离心3遍。用70%冰乙醇在-20℃冰箱固定24 h,离心去乙醇,PBS洗涤(5min×2次),离心(1000r/min)3min,弃上清液。加入Rnase A(50μg/mL)37 ℃温育30 min后,加10 μL PI(50μg/mL)置4 ℃暗处作用20min。流式细胞仪检测细胞亚二倍体峰。
1.5 细胞DNA提取及琼脂糖凝胶电泳
1.5.1 材料:cell Genomic DNA Isolation Kit(吸附柱式)琼脂糖凝胶电泳分子生物学试剂盒购自上海中科开瑞生物芯片科技股份有限公司。
1.5.2 方法:(1)培养细胞基因组DNA的提取:将200μL细胞培养物(约105个左右)加入200 μL Binding buffer,40 μL proteinase和20 μL Rnase A,立即混匀,72 ℃水浴10 min。加入100 μL异丙醇,混匀,将混合液转移到一个已经套入收集管的吸附柱内,离心(12000r/min)2 min 弃去收集管中的废液,将吸附柱放入同一收集管中。加入500 μL WB1,离心(12000r/min)1 min,倒掉收集管中的废液,将吸附柱放入同一收集管中。加入500 μL WB2,离心(12000r/min)1 min,倒掉收集管中的废液,将吸附柱放入同一收集管中(该步骤重复一次)。置于空柱离心(12000r/min)2 min。吸附柱放入一个干净的1.5 mL离心管中,在吸附柱的膜中央加入100μL Elution Buffer (65 ℃水浴预热可有效提高得率),室温静置2 min ,离心(12000r/min)1 min,离心管中所得收集物即为抽提好的组织基因DNA,-20 ℃保存。(2)琼脂糖凝胶电泳检测:直接吸取2~5 μL洗脱液于1%琼脂糖凝胶中行电泳检测。
1.6 免疫组织化学染色
1.6.1 材料:Ki-67过氧化物酶标记的链霉卵白素染色试剂盒购自北京中山生物技术有限公司。
1.6.2 方法:(1) 细胞蜡块制作参照[4],略改进。收集对照组及40、80、 160μmol/L 5-Fu分别处理24、48、72 h组细胞,各组约1×107个,D-Hanks液洗涤(5 min×2次),低速离心后加入少许蛋清甘油(1:1),用乙醇(95%)固定30 min,离心弃掉乙醇,细胞块用拭镜纸包裹,常规酒精脱水后行石蜡包埋。(2) SP法免疫组化染色:常规切片脱蜡至水。3%过氧化氢孵育10 min(以清除内源性过氧化物酶的活性),PBS洗涤(5min×2次)。微波处理修复抗原,Ki-67微波修复30 min,PCNA微波修复10 min。5%正常羊血清室温孵育15 min(以减少特异性吸附)。每张切片滴加50 μL第一抗体,40 ℃过夜后,PBS洗涤(4min×4次)。每张切片滴加50μL生物素标记二抗,37 ℃孵育35 min,PBS洗涤(4min×4次)。每张切片滴加50μL辣根酶标记链霉卵白素,37 ℃孵育1h,PBS洗涤(4min×4次)。DAB显色,自来水充分冲洗,复染,封片。(3) 阳性指数计算。免疫组化结果用NYD-1000型图像分析仪处理,随机选取10个高倍视野的肿瘤细胞共1000个,计算每100个细胞中的阳性细胞数,亦即阳性表达指数(Positive Index, PI)。
1.7 统计分析
采用方差分析,两两比较采用Dunnett-t检验。
2 结果
2.1 MTT法检测结果
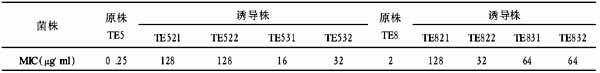
MTT法检测结果表明,5-Fu在体外可明显抑制Lovo细胞的增殖,浓度>40μmol/L作用更为明显,且呈现明显的对剂量时间依赖特点(表1)。表15-Fu对大肠癌Lovo细胞的增殖影响(注: 与10μmol/L处理组比较, *P<0.01.
2.2 倒置显微镜下观察细胞的形态学变化
2.2.1 对照组Lovo 细胞4~6 h贴壁,24 h增殖旺盛,48 h细胞呈高棱柱形、排列呈分枝丛簇状生长(图1),72h细胞生长呈致密单层状。
2.2.2 实验组Lovo 细胞经5-Fu诱导12 h后见有少数细胞皱缩,变圆变小,胞质内出现颗粒,细胞膜完整;24 h后此类细胞进一步增多,部分细胞呈圆形,细胞核与胞质分辨不清、细胞间隙增大,细胞数目减少;48 h后可见细胞呈分枝丛簇状集落生长特性明显降低,细胞多呈单个生长状态,数目已显著减少,少量细胞脱落悬浮于培养液中,大部分细胞裂解成圆形小体,另有部分细胞体积增大,呈圆形或椭圆形细胞内见颗粒状物质出现。
2.2.3 实验组在24,48,72 h后做细胞爬片和细胞腊块HE染色,可见一些细胞皱缩,核染色质浓缩深染,并向核膜聚集,核碎裂,胞浆呈伊红着色的典型的凋亡细胞形态(图2),少量细胞呈溶解坏死状态。
2.3 流式细胞仪(FCM)检测结果
2.3.1 FCM检测结果(表2)。
2.3.2 人大肠癌Lovo 细胞经5-Fu诱导后在FCM检测的含量图中显示,在G1期细胞前出现亚G峰,既凋亡峰(图 3),表明细胞DNA降解,渗漏导致DNA染色能力下降,凋亡峰随5-Fu剂量加大、作用时间延长而增高。实验发现对照组也存在少量细胞的凋亡。
表25-Fu作用不同时间对大肠癌Lovo细胞的凋亡诱导率(x±S)
组别复孔数作 用 时 间12h24h48h对照组61.60±0.312.26±0.362.80±0.3880μmol/L63.8±0.60*9.85±1.40*25.26±1.40*160μmol/L66.46±0.69*15.6±1.70*28.97±2.38* 注: 与对照组比较,*P<0.01.
2.4 琼脂糖凝胶电泳检测结果
Lovo细胞经5-Fu诱导作用后,出现典型的DNA梯形带,证明经5-Fu作用后细胞内源性核酸酶活性升高,将核小体之间的DNA切割成180~200 bp的多聚体(图4)。
2.5 免疫组织化学检测结果
免疫组化检测,Ki-67标记结果见表3,Ki-67阳性信号位于核内,均呈棕黄色。5-Fu处理组表达明显降低(图 5)。Fas蛋白免疫组化检测结果见表3,Fas的阳性反应主要定位在细胞膜,少量在浆内表达(图 6)。P53诱导前后在对照组与实验组中均无表达。 表3Fas蛋白、Ki-67免疫组化检测结果 注: 与对照组比较 ,*P<0.01。
3 讨论
近年来的研究发现,多种抗肿瘤的药物均可引起一个共同的细胞死亡模式——细胞凋亡。越来越多的证据表明,细胞的增殖、分化、凋亡三者之间平衡失调与肿瘤的发生有关,多种肿瘤存在细胞凋亡受阻现象[5],因此设法诱导肿瘤细胞凋亡,抑制其增殖以增大“死亡与增生”的比值,成为新的综合的目标。细胞凋亡的程度则成为评估疗效的一项新指标[6]。在恶性瘤细胞凋亡率开始下降前采用诱导凋亡手段,使恶性瘤细胞凋亡率保持在一定水平,使肿瘤生长受到抑制。在实验中我们发现,5-Fu体外诱导大肠癌Lovo 细胞凋亡具有对剂量和时间依赖的特点,起初凋亡百分率随诱导剂量的增加而显著增大,继续增大5-Fu浓度达80μmol/L时,凋亡率的增加再度趋缓(见表2),说明5-Fu诱导肠癌细胞凋亡可能存在“极限值”,此结果提示5-Fu化疗时合适的剂量及足够的化疗时间对保证化疗效果有重要意义。5-Fu诱导大肠癌Lovo细胞凋亡机制主是通过抑制肿瘤细胞胸腺嘧啶核苷酸合成酶(TS)活性,破坏DNA稳定性,诱导细胞凋亡。5-Fu参与多种细胞凋亡途径的调节,可以分为线粒体依赖和非线粒体依赖两条途径[7]。在线粒体依赖的途径中5-Fu的调节涉及到bax和caspase-9表达及线粒体膜电位高低等情况,而在非线粒体依赖的途径中涉及到Fas/FasL和caspase-8等变化。
关于突变型p53蛋白的表达与细胞凋亡的关系,目前的研究结果不同。有学者认为突变型p53蛋白的表达,可能增加细胞对化疗药物的耐受性[8]。我们的实验结果表明,5-Fu体外诱导大肠癌Lovo 细胞凋亡在诱导前后均不表达p53,提示突变型p53与细胞凋亡发生无关,此结论与其他学者报道相一致[9]。上述结果可能与Lovo 细胞的p53基因类型有关,因为野生型p53的表达用免疫组化无法检测[10]。Ki-67仅在增殖态细胞中表达[11],细胞中Ki-67表达增强反映肿瘤细胞具有较高增殖活性和较强的浸润和转移的潜能。5-Fu在诱导Lovo细胞凋亡的同时,Ki-67表达明显降低,该效应呈现剂量和时间依赖性。结果表明,5-FU能抑制人大肠癌Lovo细胞增殖及侵袭性,并可通过诱导该细胞系凋亡杀伤癌细胞。
Fas蛋白是属于肿瘤坏死因子受体家族中细胞表面的“死亡受体”,为Ⅰ型跨膜糖蛋白,当Fas与其体内天然配体Fas结合后,Fas相关死亡区蛋白激活caspase-8 形成死亡诱导系列信号复合物,促进 Fas蛋白所在细胞的凋亡发生[12]。实验结果表明,实验组 Fas蛋白表达和凋亡百分率值均显著高于对照组,提示5-Fu可能通过上调Lovo细胞的Fas蛋白表达水平对Fas介导的死亡信号以及相关的caspases的诱导而使肿瘤细胞发生凋亡,而上调肿瘤细胞的Fas蛋白表达水平可恢复对机体免疫监督系统Fas介导杀伤肿瘤细胞的敏感性。
以往体外肿瘤细胞培养做免疫组化染色都是用培养细胞的爬片技术,其主要缺点为:(1)细胞爬片需要爬出许多片子,造成细胞代数不一致;(2)细胞爬片易脱落,染料不易穿透细胞膜,使细胞内成分着色困难。本实验中我们参照[4]略加改进,将培养Lovo细胞制成细胞腊块,制成细胞腊块后显著优点是:只对一代的细胞进行染色,而且不需培养太多的细胞;制成细胞腊块后,因细胞处于一个平面,染料易于穿透着色。
【文献】
[1] 张浩波,王 景. 大肠癌辅助化疗新进展[J].癌症杂志 ,1998,8(4):311-312
[2]姚学清,林 锋,卿三华,等.5-氟尿嘧啶诱导人大肠癌多药耐药细胞株及细胞凋亡的实验研究[J].实用医学杂志,2006,22(10):1106-1108
[3] 季风存,程若川,康俊升.5-氟尿嘧啶诱导直肠癌HR8348细胞凋亡作用的研究[J].中国普外基础与临床杂志,2003,10(6):564-567
[4]高洁,候敏,刘彤华. 培养细胞的石蜡包埋切片用于免疫组织化学染色的优越性[J].中华病杂志, 1999,28( 6 ):459-460
[5] Evan. Littlewood TA mater of life and cell death[J].science,1998,281 (5381):1317-1322
[6] Read JC. Apoptosis-targeted the rapies for cancer[J]. Cancer cell. 2003, 3(1):17-22
[7] 程 宏,刘彦信,郑德先.5-氟尿嘧啶诱导细胞凋亡的分子机制[J].中国医学文摘肿瘤学,2003,22(1):76-77
[8]Muguruma K, Nakatk B, Hirakawa Y, et al. p53 and Bax protein expression as predictor of chemotherapeutic effect in gastric carcinomal[J]. Gan To Kagaku Ryoho, 1998,25(Suppl3): 400-403
[9] Amellem O, Sandvik J. Hypoxia-induced apoptosis in human cells with normal p53 status and function, without any alteration in the nuclear protein level[J]. Exp Cell Res,1997,232(2): 361-370
[10] Soussi T.The p53 tumor suppressor gene:from molecular biology to clinical investigation[J]. Ann N Y Acad Sci, 2000, Jun, 910:121-139
[11]Warbrick E, Heatherington W,lane DP,et al.PCNA brinding proteins in Drosophila melanogaster:the analysis of a conserved PCNA binding domain[J].Nucleic Acids Res, 1998,26(17):3925-3932
[12] O'connell J, Michael W, Bennett MW, et al. Altered mechanisms of apoptosis in colon cancer: Fas resistance and counterattack in the tomor-immune conflict [J].Ann NY Acad Sci, 2000, Jun,910: 178-195.