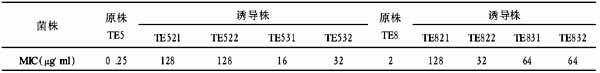
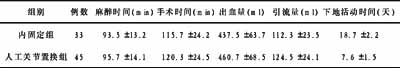
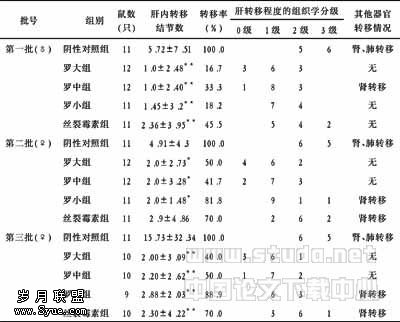
人胰高血糖素样肽-1突变体基因原核表达质粒的构建
作者:朱清 顾云,陆伟,刘梅
【摘要】 目的:对人胰高血糖素样肽-1(hGLP-1)进行基因突变,构建GST融合蛋白原核表达质粒pGEX-4T/(Val8)hGLP-1,并在大肠杆菌中诱导表达。方法:选择大肠杆菌偏爱密码子,将hGLP-1(7~37)第2位的丙氨酸(Ala8)定点突变为缬氨酸(Val8),直接生物合成4个寡聚核苷酸片段并进行基因拼接,形成完整的hGLP-1突变体基因(Val8)hGLP-1,并连接到载体pGEX-4T-1,转化大肠杆菌BL21,BamH I与Xho I双酶切电泳鉴定与序列测定,然后诱导表达其融合蛋白。结果:经酶切电泳鉴定与测序分析,证实所合成的突变体基因(Val8)hGLP-1已克隆到pGEX-4T-1中,经SDS-PAGE分析可以诱导表达出融合蛋白。结论:成功地构建了GST融合蛋白原核表达质粒pGEX-4T/(Val8)hGLP-1,为进一步获得重组hGLP-1蛋白奠定基础,为产业化规模制备hGLP-1突变体提供实验依据。
【关键词】 人胰高血糖素样肽-1;融合蛋白;基因突变;克隆;糖尿病
Construction of expression vector of human Glucagon-like peptide-1 mutant gene
[Abstract] Objective: To obtain the mutant gene of human Glucagon-like peptide-1(hGLP-1),construct the expression vector of pGEX-4T/(Val8)hGLP-1,and express the GST fusion protein in E.coli cells. Methods: With the preferential codon of E.coli being selected, four oligonucleotide fragments were directly biosynthesized, then were spliced to form a complete mutant gene of hGLP-1 which changed the codon for the second amino acid of hGLP-1(7~37)-alanine (Ala8) into valine (Val8) by means of site-directed mutagenesis, so it named(Val8)hGLP-1. The mutant gene was inserted into the vector pGEX-4T-1 with BamH I and Xho I restriction sites.The recombinant plasmid of pGEX-4T/(Val8)hGLP-1 was transformed into E. coli cells(BL21),then identified by electrophoresis after enzyme digestion and testified by DNA sequencing, further induced to express the fusion protein by IPTG. Results: The results of electrophoretic analysis and DNA sequencing confirmed that the synthetic mutant gene (Val8) hGLP-1 had been cloned into the pGEX-4T-1 successfully, and induced expression of fusion protein by SDS-PAGE analysis. Conclusion: The GST fusion protein expression plasmid of pGEX-4T / (Val8) hGLP-1 was successfully constructed,which laid the foundation for further obtaining recombinant hGLP-1 mutant for experimental or clinical studies and provided the technical routes of industrialization.
[Key words] Human Glucagon-like peptide-1; Fusion protein; Gene mutation; Cloning; Diabetes mellitus
人胰高血糖素样肽-1(human glucagon-like peptide-1, hGLP-1)是由人胰高血糖素基因编码、并由肠道L细胞分泌的一种肽类激素,它是随着食物在肠道的消化吸收过程而分泌的,其功能由hGLP-1受体(hGLP-1R)介导,是目前能诱导胰岛素分泌的最强物质之一,还能以同样的强度抑制胰高血糖素的分泌,它促胰岛素分泌的作用具有葡萄糖依赖性,随着葡萄糖浓度降低,其促胰岛素分泌作用逐渐减弱,因而hGLP-1降糖作用是自限性的,不会增加2型糖尿病患者发生低血糖的危险性,这是hGLP-1优于磺酰脲类降糖药及胰岛素最显著的特点[1,2]。另外研究发现GLP-1具有改善胰腺B细胞及胰岛功能、增加胰岛素敏感性、抑制胃排空、影响葡萄糖代谢等多种生物学作用[3,4],对机体的葡萄糖稳态调节起着十分重要的作用,因而hGLP-1对于2型糖尿病的具有很高的临床应用价值。但是GLP-1的不足之处是半衰期很短,皮下注射后很快被1种特异性的蛋白酶二肽基肽酶(dipeptidyl peptidase IV,DPP-IV)降解而失去生物活性,从而限制了GLP-1的临床应用。因此目前的研究热点是寻找能抵抗DPP-IV降解的hGLP-1类似物或DPP-IV的特异抑制剂[5]。本研究选择hGLP-1(7~37)第2位的丙氨酸(Ala8)作为突变位点,生物合成其突变体基因,构建hGLP-1突变体的表达载体,为下一步获取重组hGLP-1蛋白创造条件,使其能抵抗DPP-IV的降解,延长其生物半衰期,为开发理想的降糖多肽类药奠定基础。
1 材料与方法
1.1 材料 大肠杆菌BL21(DE3)由本实验室保存,pGEX-4T-1为Amarsham公司产品,限制性内切酶BamH I与Xho I、DL-2000 DNA Marker、λDNA/Hind Ⅲ Marker 均为TaKaRa公司产品, T4 DNA连接酶和琼脂糖为Promega公司产品,质粒抽提试剂盒为TIANGEN公司产品,预染蛋白Marker为上海Biolabs公司产品。
1.2 方法
1.2.1 hGLP-1突变体cDNA序列设计与合成 参照[6]并加以改进,以缬氨酸(Val8)取代hGLP-1 N端第二位丙氨酸(Ala8),根据其氨基酸序列,选择大肠杆菌偏爱的密码子,设计并合成待重组的含第二位点突变(Val8)密码子的(Val8)hGLP-1 cDNA序列。设计合成4个寡聚核苷酸片段(F1~F4),由英骏生物技术有限公司合成,其长度分别为:F1:54 nt;F2:54 nt;F3:58 nt;F4:50 nt;合成基因总长度为112 bp;包括位于5'端BamH I和3'端Xho I酶切位点;两个终止密码子TGA 和TAA;在GST与(Val8)hGLP-1编码序列之间加入溴化氰裂解位点蛋氨酸密码子ATG。hGLP-1突变体cDNA序列设计如下:
F1:5'-GATCCATGCACGTAGAAGGTACCTTCACCT-CTGACGTATCCTCTTACCTGGAAG-3'
F2: 5'-GCCAGGCTGCTAAAGAATTCATCGCTTGG-CTGGTTAAAGGCCGTGGTTGATAAC-3'
F3: 5'-AGCCTGGCCTTCCAGGTAAGAGGATACGT-CAGAGGTGAAGGTACCTTCTACGTGCATG-3'
F4: 5'-TCGAGTTATCAACCACGGCCTTTAACCAGC-CAAGCGATGAATTCTTTAGC-3'
1.2.2 目的基因(Val8)hGLP-1的获得(1)寡聚核苷酸的复性 分别将合成的四个寡聚核苷酸链F1、F2、F3、F4用TE溶解。分别将等摩尔的F1与F3,F2与F4进行两两复性,并使之终浓度为1 pmol/μl,复性总体系均为20 μl。复性条件均为90 ℃ 5 min、65 ℃ 10 min后静置冷却至室温;(2)双链片段的拼接:取复性好的F1F3、F2F4双链按如下体系混合各溶液:F1F3 3 μl,F2F4 3 μl ,2×DNA连接酶buffer 10 μl,T4 DNA连接酶(3 U/μl)2 μl,ddH2O 2 μl,总体系20 μl;37℃水浴孵育3~4 h。然后行2%琼脂糖凝胶电泳检测。
1.2.3 原核表达质粒pGEX-4T/(Val8)hGLP-1的构建 用BamH I和Xho I对原核表达载体PGEX-4T-1进行双酶切,将目的基因与酶切好的PGEX-4T-1原核表达载体于14~16 ℃连接3~4 h。连接产物转化BL21感受态细胞,通过氨苄青霉素(Amp)选择培养后,挑取独立、分离的单克隆4~6个,分别置于内含Amp的5 ml液体LB培养基中37℃振荡培养过夜。取培养好的菌液离心后回收菌体,质粒抽提试剂盒抽提质粒,用BamH I和Xho I进行双酶切,酶切产物行1.5%琼脂糖凝胶电泳,将酶切片段长度符合插入片段长度的重组质粒送上海英骏公司测序部测序鉴定。
1.2.4 重组诱导蛋白的表达 将所构建的重组质粒及未酶切的空载PGEX-4T-1均转入钙化菌BL21,分别挑取含重组质粒及未酶切的空载PGEX-4T-1的BL21菌体单斑至10 ml LB培养基(含Amp 50 mg/L)中37 ℃振荡培养过夜。1∶50比例稀释过夜菌,37 ℃振荡培养至OD600为0.6左右。各取1 ml诱导前的菌液作为对照组,余下的PGEX-4T-1空载菌液加入IPTG诱导剂至终浓度分别为0.3、0.5 mmol/L,含重组质粒的菌液加入IPTG诱导剂至终浓度分别为0.3、0.5、0.8 mmol/L,30 ℃诱导6 h。然后将所有的诱导表达的菌液及对照组一起,10000 g离心1 min,离心收获沉淀,用预冷的PBS洗2次后,重悬于1 ml的0.01 mol/L PBS中(其中加入10 μl的蛋白酶抑制剂)后超声破碎菌体,加入Triton-X 100 10 μl,静置5 min。4 ℃,12000 g离心40 min,取上清液。取样煮沸10 min后行12%SDS-PAGE。考马斯亮蓝染色过夜,脱色后观察GST-(Val8)hGLP-1表达的结果。并用薄层扫描仪扫描凝胶上的蛋白条带。
2 结 果
2.1 目的基因(Val8)hGLP-1的获得 将F1与F3,F2与F4进行两两复性,并将复性好的双链片段行2%琼脂糖凝胶电泳,用未复性的寡核苷酸作为对照。结果显示复性后片段迁移速度变慢,表明复性成功(见图1)。然后将两个复性好的双链片段进行基因拼接,行2%琼脂糖凝胶电泳检测,并以未拼接的双链片段作为对照。如图2所示,目的基因片段长度在110 bp左右,与所设计的hGLP-1突变体cDNA大小相符。
2.2 原核表达质粒pGEX-4T/(Val8)hGLP-1酶切鉴定与测序分析 (Val8)hGLP-1 cDNA应被插入pGEX-4T多克隆位点BamH I和Xho I之间,因此可用BamH I和Xho I对构建的重组质粒进行双酶切鉴定。琼脂糖凝胶电泳发现重组质粒经双酶切后得到一个约5000 bp的大片段和一个约110 bp的小片段,与预计结果相符(见图3)。说明含有Val8点突变的hGLP-1 基因成功插入pGEX-4T多克隆位点中。对此插入片段进行测序分析,测得目的片段全长为112 bp,且第二位氨基酸(Ala8)的密码子GCT已变成Val的密码子GTA,与实验设计完全一致(见图4)。
2.3 诱导表达重组蛋白 将重组成功的原核表达质粒以及未酶切的空载PGEX-4T-1均用IPTG进行诱导表达6 h,并分别用未诱导的重组质粒及空载PGEX-4T-1作为对照。通过SDS-PAGE考马斯亮蓝染色分析发现(见图5),以0.3 mmol/L和0.5 mmol/L浓度的IPTG诱导空载PGEX-4T-1,与诱导前相比,在相对分子量约为26 kDa处均出现一条明显的蛋白条带,与GST融合蛋白前体分子量一致。而以0.3、0.5、0.8 mmol/L浓度的IPTG诱导pGEX-4T/(Val8)hGLP-1,与诱导前相比,在分子量约为29.3 kDa处均出现明显的诱导蛋白条带(GST前体蛋白26 kDa,目的蛋白hGLP-1为3.3 kDa),这与预期分子量大小一致。凝胶分析,其表达量占菌体总蛋白量的30%~40%,各浓度的IPTG诱导结果没有明显差异。
3 讨 论
hGLP-1(1~37)全肽无活性,存于体内具有生物活性的天然形式为hGLP-1(7~37)和hGLP-1(7~36)酰胺。二肽基肽酶DPP-IV对hGLP-1(7~37)和hGLP-1(7~36)酰胺的降解主要与其N末端组氨酸(His7)和第2位丙氨酸(Ala8)有关,因而目前对于hGLP-1类似物的开发主要是围绕这两个氨基酸来进行。评价某种hGLP-1类似物是否具有潜在开发价值可以根据以下几点[7]:(1)能否抵抗DPP-IV的降解;(2)与hGLP-1R结合的亲和力;(3)升高细胞内cAMP的能力;(4)促胰岛素分泌的能力;(5)对于2型DM的降糖活性。Gallwitz等[8]对hGLP-1不同位点的氨基酸进行突变,结果表明,His7残基的修饰可使hGLP-1抵抗DPP-IV的降解,但其与受体的亲和力明显下降,而Ala8残基被取代或修饰的突变体,不仅能抵抗DPP IV的降解,且与受体的亲和力及体内的生物活性与hGLP-1相比没有明显下降。有学者研究用缬氨酸(Val)替代hGLP-1的Ala8,即(Val8)hGLP-1,它能够抵抗DPP-IV的降解,虽然与受体的亲和力稍微有所降低,但是其升高细胞内cAMP、促胰岛素分泌的能力以及降血糖等生物活性明显超过了天然hGLP-1[9]。这说明(Val8)GLP-1具有良好的开发应用前景。而国外一般采取化学合成法,比较直接、省事,但产量少,所需成本较高,不适合于大规模生产,而国内对GLP-1的开发研究还处于起步阶段。
本实验采用基因工程的方法[10],对人胰高血糖素样肽(hGLP-1) N端的第二位丙氨酸(Ala8)进行突变,以缬氨酸(Val8)来代替,将(Val8)hGLP-1突变体基因克隆到原核表达质粒pGEX-4T-1中,构建了pGEX-4T/(Val8)hGLP-1重组质粒。转化大肠杆菌后,进行酶切鉴定,表明(Val8)hGLP-1成功构建到pGEX-4T-1中。经序列测定分析,(Val)hGLP-1其第二位氨基酸已由原来的Ala的密码子GCT突变成Val的密码子GTA,这与实验设计的cDNA序列完全一致,并以正确的阅读框架插入pGEX-4T。转化大肠杆菌后,以不同浓度的IPTG诱导表达其融合蛋白,30 ℃诱导6 h,发现诱导表达的融合蛋白GST-(Val8)hGLP-1分子量约为29.3 kDa,除去融合蛋白前体GST分子量26 kDa,(Val8)hGLP-1本身分子量为3.3 kDa左右,与理论值相符。而各浓度的IPTG诱导结果没有明显差异。
本研究成功构建了含Val8点突变的hGLP-1基因的原核表达质粒,并诱导表达融合表达蛋白。这为进一步获取(Val8)GLP-1蛋白纯品,开发出具有自主知识产权的2型糖尿病的新药打下坚实基础,并为产业化规模制备提供了实验依据。
【】
[1] Vilsboll T, Krarup T, Madsbad S, et al. No reactive hypoglycaemia in type 2 diabetic patients after subcutaneous administration of GLP-1 and intravenous glucose[J]. Diabet Med, 2001,18(2):144-149.
[2] 乐嘉静,李湛君,邱财荣,等. 重组人胰高血糖素类多肽-1(7-36)对正常动物降糖作用的实验研究[J]. 中华临床药与治疗学, 2004, 9(5):527-531.
[3] De L, Diva D, Deng SP, et al. Role of endogenous glucagons-like peptide-1 in islet regeneration after partial pancreatectomy[J]. Diabetes, 2003,52(2):365-371.
[4] Zander M , Medsbad S, Madsen JL, et al. Effect of 6-week course of glucagons-like peptide-1 on glycaemic control ,insulin sensitivity, and β-cell function in type 2 diabetes: as parallel -group study[J]. Lancet, 2002, 359(9309):824-830.
[5] Neumiller JJ, Odegard PS, White JR Jr,et al, Looking to the future: focus on DPP-4 inhibitors for the treatment of type 2 diabetes and emerging therapies[J]. Diabetes Education, 2008,34(2):183-200.
[6] 张志珍,毛积芳,窦 鸿,等. 人胰高血糖素样肽-1 cDNA的克隆与表达[J]. 第二军医大学学报,2001,22(4):316-318.
[7] Green BD, Gault VA, O'harte FP,et al. Structurally modified analogues of glucagon-like peptide-1 (GLP-1) and glucose-dependent insulinotropic polypeptide (GIP) as future antidiabetic agents[J]. Curr Pharm Des, 2004,10(29):3651-3662.
[8] Gallwitz B, Ropeter T, Morys-Wortmann C, et al. GLP-1-analogues resistant to degradation by dipeptidyl-peptidase IV in vitro[J]. Regul Pept, 2000, 86(1-3):103-111.
[9] Green BD, Mooney MH, Gault VA, et al. N-terminal His(7)-modification of glucagon-like peptide-1(7-36) amide generates dipeptidyl peptidase IV-stable analogues with potent antihyperglycaemic activity[J]. Journal of Endocrinology, 2004,180(3):379-388.
[10] 尹晓敏,施建华,刘 飞. 剪接因子SRp55原核表达质粒的构建和表达[J]. 南通大学学报(医学版),2007,27(2):79-82.