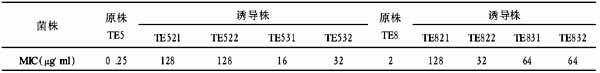
钯催化Suzuki偶联高效合成2-烷基取代碳青霉烯类衍生物
【摘要】 目的 高效合成多个2-烷基取代碳青霉烯类化合物。方法 通过钯催化下三氟甲磺酰碳青霉烯与烷基硼经由Suzuki偶联高效合成2-烷基取代碳青霉烯化合物。结果 反应合成得到多个目标产物,反应条件温和,收率理想。结论 在合成2-烷基取代碳青霉烯化合物的简便方法中,由于在C-2位引入了烷基链,由此可制备一系列具有临床应用价值的2-烷基取代碳青霉烯类化合物。
【关键词】 钯;碳青霉烯类;Suzuki偶联
Abstract: Objective To synthesize some typical 2-alkylcarbapenems derivatives conveniently. Methods Palladium-catalyzed Suzuki coupling reaction of alkyboranes with carbapenem-2-yl triflates. Results Under mild conditions, the reactions ran smoothly and four 2-alkylcarbapenems derivatives were prepared conveniently in good yield. Conclusion An advantage of this procedure is the introduction of alkyl side chain at C-2 position at the later stage of the synthesis, thus allowing the synthesis of a wide variety of functional 2-alkylcarbapenems more accessible.
Key words: palladium; carbapenems; Suzuki coupling
碳青霉烯类药物是20世纪80年代开始的一组新型广谱的β-内酰胺类抗生素,用于临床不过十余年,对控制耐药菌、产酶菌感染和免疫缺陷者感染,发挥了极其重要的作用[1~4]。碳青霉烯类抗生素的抗菌谱极广,对绝大多数革兰阳性与阴性菌、需氧菌与厌氧菌均具有良好的抗菌作用。对甲氧西林敏感的葡萄球菌、肺炎球菌、链球菌属、粪肠球菌的作用亦优于头孢噻吩。基于其重要性,国内外众多研究者纷纷对其系列衍生物合成、构效及药展开深入研究,以发展更多具有临床意义、抗菌谱更广的碳青霉烯类药物[5,6]。
目前大多最新合成的碳青霉烯类化合物为类硫霉素结构,其特点为支链通过硫原子在C-2位与碳青霉烯母环相连或通过烷基在C-2位与碳青霉烯母环相连。如目前已推向市场的亚胺培南(imipenem,1a,图1)、美罗培南(Meropenem,4a,图1)等,目前国内外针对于化合物1-4,大多通过碳青霉烯母环成环前先引入所需支链,随后使C-1与C-2环合合成得到目标碳青霉烯类化合物,合成步骤普遍长,且由于方法的局限性,合成的化合物数量很有限[7]。笔者将结合课题组以往工作[8,9],报道1种通过钯催化下三氟甲磺酰碳青霉烯与烷基硼经由Suzuki偶联高效合成2-烷基取代碳青霉烯类化合物的方法,通过该合成方法,碳青霉烯母环的生物活性得到充分保留。
图1 典型碳青霉烯类化合物(略)
1 实验部分
1.1 仪器和试剂 产物定量分析用VARIAN3700型气相色谱仪(美国Varian公司),色谱柱:V1701 0.2mm×25mm,柱温:75℃(5mm),程序升温:10℃/min,汽化室:270℃,氢焰离子检测器:300℃,进样0.2μl,载气为氮气。数据由HP3394积分仪处理。 产物结构分析:GC-MS用美国HP6890-5937 GC-MS 联用仪;色谱柱:高弹性石英毛细柱HP-5,30mm×0.25mm;柱温:75℃(5min)→250℃(10min); 程序升温:10℃/min;分流比:150∶1;载气为氮气;进样口温度:280℃;界面温度:280℃;EI源(能量:70ev);离子源温度:230℃;四极杆温度:150℃;数据处理系统:Hewlett-Packard MSD 化学工作站。IR用美国Amalect公司RFX-65型FTIR仪测试;1H NMR用Brucker DRX-400 Advanced仪器(瑞士Brucker公司)测定,溶剂CDCl3,内标TMS;元素分析采用Heraeus CHN-O快速分析仪。X-衍射选用Bruker SMART APEX X衍射仪。HF254硅胶板进行TLC跟踪分析。PdCl2(dppe)、PdCl2(dppb)等催化剂、四氢呋喃等均为上海化学试剂有限公司产品,分析纯。
1.2 典型实验操作 冰浴下往4-甲氧基苯基-N-烷基氨基甲酸酯(600mg, 2.71mol)的THF(3ml)溶液中滴加9-BBN的THF溶液(0.5M, 8.1ml, 4.1mmol),搅拌反应2h,随后三氟甲基磺酰碳青霉烯类化合物5a(4.1mmol)的THF(8ml)溶液被逐步滴加到前述反应体系中,加入PdCl2(dppe)催化剂(0.70mg,0.14mmol)以及2mol/L的NaOH溶液(1.36ml, 2.7mmol),冰浴下搅拌1h,逐步加热反应体系至60℃反应3h,反应完全后,反应混合物倾入水中并用乙酸乙酯萃取,萃取液用饱和氯化钠溶液洗涤数次,无水硫酸镁干燥。旋转蒸发除去乙酸乙酯溶剂得粗产物。粗产物经柱纯化得到产物6a(1.54g,87.5%)。
2 结果
见表1。
表1 不同钯催化剂催化Suzuki偶联合成C-2烷基取代碳青霉烯类化合物(略)
注:a:反应条件:冰浴下往4-甲氧基苯基-N-烷基氨基甲酸酯(600mg, 2.71mol)的THF(3ml)溶液中滴加9-BBN的THF溶液(0.5M, 8.1ml, 4.1mmol), 搅拌反应2h,随后三氟甲基磺酰碳青霉烯类化合物5a或5b(4.1mmol)的THF(8ml)溶液被逐步滴加到前述反应体系中,加入PdCl2(dppe)催化剂(0.14mmol,或其它指定催化剂)以及2mol/L的NaOH溶液(1.36ml, 2.7mmol),冰浴下搅拌1h,逐步加热反应体系至60℃反应2h,反应完全后,反应混合物倾入水中并用乙酸乙酯萃取,萃取液用饱和氯化钠溶液洗涤数次,无水硫酸镁干燥。旋转蒸发除去乙酸乙酯溶剂得粗产物。粗产物经柱层析纯化得到产物。b:选用PdCl2(dppb)为催化剂;c:选用PdCl2(dppf)为催化剂;d:选用PdCl2为催化剂。
注:产物结构分析6a:1H NMR (400MHz, CDCl3)δ0.59 (q, 6H), 0.95(t, 9H),1.26(d, 3H),1.59-1.74 (m, 2H),2.57-2.67(m,2H),2.81(d,2H),3.05(dd,3H),3.02-3.18(m,2H),3.78(s,3H),3.80(s,3H),4.06(dt,1H),4.18(q,1H),5.03(s,2H),5.00-5.16(br,1H),6.86(d,2H),7.31(d,2H),7.36(d,2H); 13C NMR(75 MHz, CDCl3)δ4.92,6.81,25.4,27.7, 40.0,40.3,52.0,55.1,66.2, 66.8, 113.8, 127.6, 128.9, 129.9, 149.4, 156.6,159.4, 161.5, 176.5; HRMS calcd for C35H38N2O8SiNa[M+Na]+ 675.3075,Found 675.3077; IR(CHCl3 cm-1) 3442,1772, 1711。
1b: 1H NMR(400MHz, D2O) δ: 1.27 (d, 3H), 1.71-1.91 (m, 2H), 2.46-2.75(m, 2H), 2.87(d,2H),3.20-3.42(m,3H), 4.11(dt,1H),4.20(q,1H),7.75(s,1H); Anal.Calcd for C13H19N3O4·2.1H2O: C,48.93;H,7.33;N,13.17. Found: C, 48.87; H, 7.03; N, 13.08.
3 讨论
反应中,三氟甲磺酰碳青霉烯5a,5b可通过成熟方法制备[10,11]。烷基硼则通过烯烃与9-BBN硼氢化反应制得。控制反应温度为60℃,在0.5% PdCl2(dppe)(1,2-二(二苯膦基)乙烷二氯化钯(II))催化下,反应可在四氢呋喃溶剂及1当量2mol/L的NaOH溶液中顺利进行(见图2)。
图2 钯催化Suzuki偶联合成C-2烷基取代碳青霉烯(略)
图3 C-2位不同取代碳青霉烯类化合物的合成(略)
如图3,利用钯催化Suzuki偶联方法,我们合成得到一组C-2位烷基取代碳青霉烯类化合物(6a, 6b, 7,图3),如合成化合物7时,我们可经适当结构烯烃与9-BBN硼氢化反应制备得到具有极佳抗菌活性的顺-吡咯烷衍生物(8,图3),随后经Suzuki偶联反应将具极佳抗菌活性该结构通过C-2位连上碳青霉烯母环,从而合成得到化合物7。类似的,我们通过Suzuki偶联反应在THF中顺利进行生成产物6a、6b,1b(图3)。
我们同时以化合物6a为研究对象,研究了不同催化剂对该Suzuki偶联反应的催化作用。如表1,我们分别选用了PdCl2(dppe)[1,2-二(二苯膦基)乙烷二氯化钯(II)]、PdCl2(dppb)[1,2-二(二苯膦基)丁烷二氯化钯(II)]、PdCl2(dppf)[1,1'-二(二苯膦基)二茂铁二氯化钯(II)]以及PdCl2为催化剂进行反应研究,研究发现,PdCl2(dppb)、PdCl2(dppf)、PdCl2三种催化剂催化效果较PdCl2(dppe)有所降低,在无配体的PdCl2催化下,反应收率较其它催化剂显著降低(52.0%,entry 4, 表 1),而在PdCl2(dppe)催化下,化合物6a可获得最佳收率(87.5%, entry 1, 表1)。
研究发现,反应时间,反应温度对反应均有一定影响,如当反应时间为1h时,反应仅以56.8%的收率得到产物6a(entry 9, 表1)。
有趣的是,即使在室温下,在PdCl2(dppe)催化下反应3h,反应仍可以49.0%的产率得到产物6a,显示出该偶联反应应用的广泛性(entry 7, 表1),但温度过高将导致产率有所下降(83.9%,entry 3, 表1),反应可能发生部分副反应。
类似的,我们也分别以较好的收率合成得到碳青霉烯类化合物1b,6a以及7,产率分别为83.5%、82.3%、80.2%(entry 12,entries 5,6,表1)。
综上所述,我们报道了1种钯催化下三氟甲磺酰碳青霉烯与烷基硼直接经由Suzuki偶联简便合成2-烷基取代碳青霉烯化合物的方法,该方法使得在建立碳青霉烯骨架后C-2位引入不同取代烷基变得格外便利,且合成得到的一系列化合物均显现出广阔的临床应用价值。
【文献】
[1] 王永赓,钱广鸿.碳青霉烯类抗生素的比较及临床应用[J].基层医学,2007,11(3):265-267.
[2] 刘小平.尼群地平的合成[J].湘潭大学学报,1998,20(2):77-78.
[3] 卢炜,徐晓光,赵利枝.碳青霉烯类抗生素-多尼培南[J].齐鲁药事,2006,25(9):574-576.
[4] 张永龙,李家泰.Meropenem,一个新的碳青霉烯类抗生素[J].临床药杂志,1998,14(3):174-176.
[5] 赵燕芳,郝金恒.美罗培南三水合物的合成[J].中国药物化学杂志,2005,64(4):97-99.
[6] 刘倩,吴松,梁晓天.1-β-甲基碳青霉烯类抗生素关键中间体的合成进展[J].中国药物化学杂志,2003,54(8):241-248.
[7] 胡来兴.1-β-甲基碳青霉烯双环母核的合成[J].中国医药杂志,2001,32(11):512-515.
[8] 赵进,程金生.新型高效钯催化下不同取代炔烃的低聚反应[J].湘潭大学自然科学学报,2006,28(3):72-76.
[9] Cheng JS, Wei GF, Huang SW, et al. Solvent-controlled chemoselective palladium-catalyzed oligomerization of tert-butyl Acetylene [J]. J Mol Catal A:Chemical,2007,263(1-2):169-174.
[10] Itani H. Uyeo S. Two Practical Syntheses of a Key Intermediate of 1β-Methylcarbapenem Antibiotics [J]. Synlett,1995,25(3):213-214.
[11] Uyeo S, Itani HA. Simple and stereocontrolled synthesis of a1 beta-methylcarbapenem key intermediate by means of organosilicon chemistry [J]. Tetrahedron Lett,1991,1919(32):2143-2144.