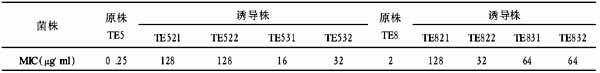
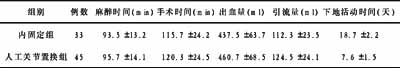
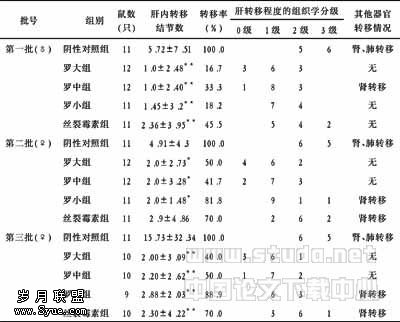
Sox9基因真核表达载体的构建及其诱导大鼠骨髓基质细胞定向分化为骨骺干细胞
作者:胡伟华,陈安民,郭风劲,李锋,黄晖,张伟凯
【摘要】 [目的] 从永生化骨骺干细胞中克隆Sox9基因并构建真核表达载体,并探讨Sox9诱导骨髓基质细胞向骨骺干细胞分化的可能性。[方法]以RT?PCR方法获得Sox9全长,插入pGEM?T Easy克隆载体中,测序正确后与pEGFP?IRES2表达载体酶切后连接,复合质粒以脂质体法转染骨髓基质细胞,观察转染效率,Sox9和 FGFR?3的表达。流式细胞术鉴定细胞表型,MTT法检测细胞增殖活性。[结果]成功的完成了Sox9的扩增和表达载体的构建 ,重组载体转染骨髓基质细胞后能检测到Sox9、FGFR?3的表达,增殖活性与骨骺干细胞无异。[结论]成功构建了Sox9真核表达载体,其能诱导骨髓基质细胞分化为骨骺干细胞并具有其特性。
【关键词】 骨骺干细胞; Sox9; 骨髓基质细胞; 转染
Abstract:[Objective]To construct eukaryotic expression vector containing Sox9 derived from immortalized precartilaginous stem cells and to probe its inductive effect on marrow stroma cells differentiating into precartilaginous stem cells.[Method]Sox9 was obtained with RT-PCR and then inserted into pGEM-T Easy cloning vectors.pEGFP-IRES2-Sox9 was established after sequencing.Then it’s transfected into marrow stroma cells.The expression of Sox9 and FGFR-3 was detected by Western-blot and immunohistochemisty.Identification and proliferation was determined by flow cytometry and MTT.[Result]Sox9 cloning and expression vector construction was achieved.Sox9 and FGFR-3 expression was identified in marrow stroma cells after transfection,whose proliferation activity was similar to precartilaginous stem cells.[Conclusion]Sox9 eukaryotic expression vector has been successfully established.Sox9 can induce marrow stroma cells to differentiate into precartilaginous stem cells.
Key words:precartilaginous stem cells; Sox9; marrow stroma cells; transfection
骨骺干细胞(precartilaginous stem cells,PSCs)是控制生长期动物肢体生长、能定向分化的成体干细胞[1]。它作为组织工程的种子细胞,可用于软骨与骨缺损的细胞替代[2]。PSCs第5代即开始分化,且取材困难,原代细胞培养技术尚不能在体外获得大量表型一致的PSCs[3]。将来源容易的骨髓基质细胞(marrow stroma cells,MSCs)诱导分化至PSCs,有望解决此难题。而Sox9抑制骨骺细胞的终末期分化,延长软骨的成熟过程并抑制其凋亡。为此,笔者构建真核表达载体pEGFP?IRES2?Sox9,并转染MSCs,以期诱导分化为PSCs,为研究骨骺细胞分化机制及组织工程提供稳定的细胞来源。
1 材料和方法
1. 1 实验材料及主要试剂
永生化骨骺干细胞株、菌种E. coli?DH5α由同济骨科实验室保存,DMEM/F12培养基和胎牛血清(Gibco),Trizol Reagent( Toyobo),兔多克隆抗体FGFR?3/c?15(Santa Cruz),RT?PCR试剂盒(Toyobo),BamHI、EcoRI、pGEM?T Easy(Promega),pEGFP?IRES2(Initrogen),LipofectamineTM2000(Invitrogen),Ⅱ型胶原及X型胶原抗体(Promega),一抗兔抗鼠CD44、CD45、CD34及二抗Alexa Fluor goat anti?rabit IgG(Sigma)。
1. 2 引物设计
根据GeneBank (NM012636)序列编码区自行设计引物(分别含BamHI和EcoRI酶切位点),由上海英骏生物公司合成,上游序列为:5'?ATG GAA ATC ACG GAA GAG CGT C?3,下游序列为:5'?GTG CTG AAG GGC TAC GAC TGG A?3。
1. 3 方法
1. 3. 1 Sox9基因的RT?PCR 取第3代IPSCs约106数量级,按Trizol Reagent Kit说明书操作,一步法提取总RNA,测浓度后取约2 μg总RNA作为逆转录模板,根据逆转录试剂盒操作说明合成cDNA第1链, PCR反应:95 ℃预变性5 min,94℃变性1 min;62 ℃退火45 s;72 ℃延伸50 s;经35个循环,72 ℃ 延伸10 min。取5μL反应产物,以0. 2%琼脂糖凝胶电泳,初步鉴定扩增产物。
1. 3. 2 Sox9克隆载体的构建和测序 经PCR Biospin试剂盒回收纯化的PCR产物克隆入pGEM?T Easy载体,蓝白筛选。然后通过菌液PCR和单酶切鉴定阳性克隆,送英骏公司测序。
1. 3. 3 Sox9真核表达载体的构建 测序正确的pGEM T?Sox9质粒以BamHI、EcoRI双酶切,并回收含有Sox9的片段,再与同样经过上述双酶切回收的pEGFP?IRES2片段连接,经卡拉霉素筛选,双酶切鉴定。
1. 3. 4 MSCs的分离、纯化与扩增 按照董飞[4]的方法获得原代大鼠MSCs,5%CO2,100%湿度,37℃培养48 h后换液。以后每3~ 4 d换液1次,7~ 10 d传代,贴壁法纯化,扩大培养。
1. 3. 5 pEGFP?IRES2?Sox9质粒转染MSCs 待24孔板中MSCs长至60%丰度,按Lipofectamine TM 2000操作说明将质粒pEGFP?IRES2?Sox9转染细胞,4 h后去掉无血清培养基,加入完全培养基,48 h后按终浓度300 μg/ml加入G418高压筛选12~ 14 d,抗性克隆以含200 μg/ml G418培养基扩大培养。培养48 h后,DPI标记胞核,用荧光显微镜检测,Image?Pro Plus转染率=胞浆绿色细胞数/胞核红色细胞数。
1. 3. 6 Western?blot、RT?PCR检测转染后MSCs的Sox9表达
RIPA裂解转染后MSCs,BCA法蛋白定量,电泳,转膜,封闭2 h,一抗兔抗鼠Sox9 IgG(1∶1 000)4℃孵育过夜,TBS?T漂洗3次。二抗羊抗兔 (1∶500)室温孵育1 h,TBS?T漂洗3次,ECL显影。用RT?PCR检测转染后MSCs中Sox9的表达,步骤同1. 3. 1。
1. 3. 7 免疫组化和Western?blot检测转染后MSCs的FGFR?3表达 MSCs转染后12d,细胞爬片,免疫组化试剂盒检测,一抗为兔多克隆抗体FGFR?3(c?15),二抗为羊抗兔IgG?HRP。检测FGFR?3的Western?blot步骤同1. 3. 6。
1. 3. 8 流式细胞术鉴定表型 流式细胞仪检测MSCs转染后30 d的抗原表达情况并分析其所占比例,常规操作。一抗为兔多克隆抗体FGFR?3(c?15)和X型胶原,二抗为PE标记和FITC标记的羊抗兔IgG。
1. 3. 9 MTT法检测细胞增殖活性 胰酶消化MSC转染后30 d及第2代PSCs(PSCs2),3×103/孔接种于96孔板。测吸光度前加入5 g/L的MTT溶液20 μl,上机前吸出培养液,加入150 μl DMSO,酶标仪490 nm处测吸光度,重复5次。
2 结 果
2. 1 目的片段的扩增
从IPSCs中提取的总RNA测OD260为0. 2635,OD260 /OD 280为1. 8741,证明提取的总RNA浓度及纯度高,符合RT?PCR的要求。PCR产物经电泳可得到约2 000 bp的特异性条带(图1)。
2. 2 重组克隆载体的酶切鉴定及测序
pGEM T?Sox9经单酶切后得到一条2 000 bp的目的条带和一条约3. 0 kb的线性化质粒条带。基因测序结果与Gene bank登陆序列进行Blast对比,结果显示碱基序列完全一致(图2)。
2. 3 重组表达载体的酶切鉴定
将pEGFP?IRES2?Sox9双酶切后电泳可得与Sox9大小相同的片断和约5. 3 kb的片断(图3)。说明Sox9基因已经成功连接到pEGFP?IRES2多克隆位点中的BamHI、EcoRI酶切位点之间,重组真核表达载体构建正确。
2. 4 观察转染效率
多数转染后MSCs胞浆表达绿色荧光,同时其胞核表达红色荧光(图4),5个视野,其转染率为50. 14%±2. 68%。
2. 5 转染后MSCs的Sox9的表达
pEGFP?IRES2?Sox9转染MSCs后,细胞Sox9 mRNA水平明显升高(图5),而转染空载体的细胞无明显变化,内参为409bp的β?actin。转染后细胞高表达Sox9蛋白,而转染空载体的细胞中低表达Sox9蛋白 (图6) ,说明Sox9成功转入MSCs中,并稳定表达。
2. 6 转染后MSCs的FGFR?3的表达
免疫组化和Western?blot结果均显示MSCs转染后12 d表达FGFR?3(图7、8)。
2. 7 流式细胞术鉴定
以FGFR?3和X型胶原作为标记物进行流式细胞术鉴定,结果显示大部分细胞(79. 1%)处于第1象限(图9),提示为FGFR?3阳性而X型胶原阴性细胞,为PSCs。
2. 8 细胞增殖活性
转染后细胞增殖活性与PSCs2相比,无显著差异(P>0. 05)(图10)。
3 讨 论
PSCs是在新生动物La Croix环中新发现的一种干细胞,特异性表面标记物为FGFR?3,因其具备定向分化能力,已成为软骨组织工程中的潜力种子细胞[1]。但是现在PSCs的来源绝大部分取自幼体的骨骺软骨,尚未建立成熟动物PSCs的稳定来源[5]。这为其应用于细胞移植及骨骺的再生带来障碍。
Sox9分布广泛,在胎儿长骨的软骨膜和处于静止期、扩增期的软骨中以及过度生长区都有较强的表达,提示Sox9基因是调控软骨发生的重要转录因子。在MSCs向软骨细胞分化的过程中,Sox9表达关闭则分化停滞,其结合软骨细胞特征分子Ⅱ型胶原、aggrecan蛋白的增强子元件,激活表达,调控软骨分化从而控制骨骺的增殖及分化[6]。为此,笔者考虑Sox9的过表达或许能诱导MSCs分化并停留在PSCs阶段。
MSCs是一种具有多分化潜能的干细胞,已广泛应用于组织工程[7]。目前对其离体诱导成骨研究多是加载外源性因子使之直接分化为成骨细胞这一较为终末的细胞[8]。如何将MSCs的分化过程阻断,使之停留在PSCs这一次分化状态?笔者尝试以一种全新的方法获得PSCs,并初步研究了其分化信号途径。
笔者利用RT?PCR技术,在体外获得了具有编码Sox9全部功能的基因片段克隆。然后利用限制性内切酶将其连接到真核表达载体中,DNA测序证实重组真核表达载体pEGFP?IRES2?Sox9构建成功,转染MSCs。Western?blot和RT?PCR检测到转录水平和蛋白水平的表达,证实Sox9已稳定转导入MSCs基因组中。转化后第4~ 12 d的细胞,均检测到高表达FGFR?3,并在体外培养体系中稳定表达至第30 d,流式细胞术鉴定绝大部分细胞表达PSCs的特异性标记物FGFR?3,且增殖活性与PSCs相比无显著差异。以此证明,转染质粒pEGFP?IRES2?Sox9后,MSCs被诱导分化为PSCs,并停留在该次分化状态。
笔者在国内率先克隆出Sox9基因并构建了pEGFP?IRES2?Sox9真核表达载体,建立了稳定的PSCs细胞株,对PSCs的分化调控机制进行了初步探讨。本研究证实利用Sox9基因诱导MSCs分化为PSCs是一种可行的、可重复的建系方法。不仅为PSCs的进一步研究建立了关键的细胞平台,而且为骨关节疾病的细胞移植提供了稳定可靠的种子细胞来源,同时为应用外源基因载体进行基因治疗奠定了坚实的基础。
【】
[1] Robinson D,Hasharoni A,Cohen N,et al.Fibroblast growth factor receptors?3 as a marker for precartilaginous stem cells[J].Clin Orthop,1999,357:163-175.
[2] Robinson D,Ash H,Yayon A,et al.Characteristics of cartilage biopsies used for autologous chondrocytes transplantation[J].Cell Transplant,2001,2:203-208.
[3] 张树威,陈安民,郭风劲,等.大鼠骨骺干细胞的分离鉴定及其永生化细胞株的构建[J].矫形外科杂志,2007,16:1245-1248.
[4] 董 飞,陈鸿辉,杨小红,等.骨髓间充质干细胞促进骨-肌腱结合部愈合的初步观察[J].中国矫形外科杂志,2007,16:1249-1252.
[5] Kinkel MD,Yagi R,McBurney D.Age?related expression patterns of Bag-1 and Bcl-2 in growth plate and articular chondrocytes[J].Anat Rec A Discov Mol Cell Evol Biol,2004,2:720-728.
[6] Pan Q,Yu Y,Chen Q,et al.Sox9,a key transcription factor of bone morphogenetic protein?2?induced chondrogenesis,is activated through BMP pathway and a CCAAT box in the proximal promoter[J].J Cell Physiol,2008,1:228-241.
[7] Abdallah BM,Kassem M.Human mesenchymal stem cells:from basic biology to clinical applications[J].Gene Ther,2008,2:109-116.
[8] Atkins GJ,Kostakis P,Welldon KJ,et al.Human trabecular bone?derived osteoblasts support human osteoclast formation in vitro in a defined,serum?free medium[J].Cell Physiol,2005,3:573-582.