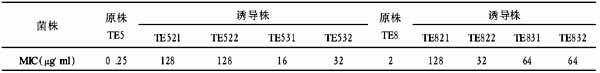
双相陶瓷生物活性骨的制备及其细胞相容性研究
作者:彭吾训,王蕾,李彦林,修晓光,赵宏斌,龚跃昆,赵学凌,李世和,胡蕴玉
【摘要】 [目的]制备一种双相陶瓷生物活性骨,并了解其细胞相容性。[方法] 分离培养兔骨髓基质干细胞(mesenchymalstemcells, MSCs),将浓度为1×106/ml的第3代MSCs接种于复合有I型胶原、骨形态发生蛋白(bone morphogenetk protein,BMP)和碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)的双相陶瓷生物骨(bniphask ceramic bioiogic bone,BCBB)上,联合培养,用倒置相差显微镜、扫描显微镜观察,测定光密度(OD)值,了解双相陶瓷生物活性骨BCBB/BMP/bFGF的细胞相容性。[结果]BCBB孔内充满I型胶原、BMP及bFGF。MSCs在双相陶瓷生物活性骨BCBB/BMP/bFGF上黏附生长,第6 d时细胞在材料表面形成致密细胞层,增殖达稳定状态。[结论]该研究制备的双相陶瓷生物活性骨BCBB/BMP/bFGF具有良好的细胞相容性。
【关键词】 双相陶瓷生物骨; 骨形态发生蛋白; 碱性成纤维细胞生长因子; 骨髓基质干细胞; 生物相容性
Abstract: [Objective]To prepare a kind of biphasic ceramic biologic active bone and study its biocompatibility. [Method]Biphasic ceramic biologic bone(BCBB) was mixed with collage type I, bone morphogenetic protein (BMP) and basic fibroblast growth factor (bFGF) , and then the third generation cultured rabbit bone mesenchymal stem cells (MSCs) were seeded on BCBB/BMP/bFGF in vitro.The tissue engineering bone(BCBB/BMP/bFGF/MSCs) was observed by upside down microscope, scanning electron microscope (SEM) and examined using methylthiazol tetrazolium (MTT).[Result]Biphasic ceramic biologic active bone BCBB/BMP/bFGF was successfully prepared by reconstituting collage type I, BMP,bFGF and BCBB together. The rabbit cells grew in and on the BCBB/BMP/bFGF to form an ideal tissue engineering bone, and the cells quantity was the most on the 6th day.[Conclusion]BCBB/BMP/bFGF possesses a good biocompatibility with rabbit bone mesenchymal stem cells.
Key words:biphasic ceramic biologic bone(BCBB); bone morphogenetic protein; basic fibroblast growth factor; mesenchymal stem cells; biocompatibility
骨组织工程的研究主要集中在支架材料、种子细胞、生长因子、组织器官的构建等方面,而支架材料细胞相容性是材料能否应用于临床的重要因素。骨髓基质干细胞(Mesenchymal stem cells, MSCs)是目前骨组织工程最有临床应用前景的种子细胞[1]。骨形态发生蛋白(bone morphogenetic protein,BMP)和碱性成纤维细胞生长因子(basic fibroblastg rowth factor,bFGF)是近来研究得较深入的两种骨生长因子[2]。本研究将兔MSCs分离培养后,与复合有BMP和bFGF的双相陶瓷生物骨(biphasic ceramic biologic bone,BCBB)联合培养,了解双相陶瓷生物活性骨BCBB/BMP/bFGF的细胞相容性,为进一步研究奠定基础。
1 材料和方法
1.1 双相陶瓷生物活性骨(BCBB/BMP/bFGF)的制备
BMP由第四军医大学西京全军骨科研究所提供,已经小鼠肌袋实验证明有骨诱导活性。称取600 mg BMP溶于10 ml浓度为4 mol/L盐酸胍溶液中,置4℃冰箱中保存24 h后,取出后匀浆,然后4℃透析48 h,每24 h更换透析液1次,得到BMP溶液。取碱性成纤维细胞生长因子(bFGF)每支150万IU/mg,用1 ml蒸馏水溶解后,分装为10份,每份100 μL含bFGFl5万IU。分别各取bFGF溶液96 000 IU(64 000 ng)。取I型胶原溶液20 ml,与上述BMP溶液和bFGF溶液混合,电磁震荡器震荡10 min,将混合液与60块0.5 cm×0.5 cm×0.5 cm大小的BCBB骨粒及5 mm×5 mm×1 mm薄片20块充分混匀(每块骨粒含BMP10 mg,bFGF 1 600 IU),负压抽吸、冻干,制得双相陶瓷生物活性骨。环氧乙烷消毒后无菌条件下封装备用,同时留样品送细菌培养,并证实无细菌生长。
1.2 双相陶瓷生物活性骨的结构观察
从冻干后的双相陶瓷生物活性骨中取样,做扫描电镜(SEM)观察。
1.3 MSCs的分离培养
两周龄日本大耳兔5只,昆明医学院动物中心提供,体重约150~200 g(合格证号:滇实动证第2003064号)。脱颈处死,0.1%的新洁尔灭中浸泡10 min,无菌条件下剥离出双侧股骨、胫骨,PBS冲洗3遍。注射器吸取L-DMEM培养基冲洗股骨、胫骨髓腔,将含有骨髓的冲洗液转入离心管, 800 r/min离心10 min,弃去上清液,加入L-DMEM完全培养基10 ml(青霉素100 U/ml,链霉素100 μg/ml,15%新生牛血清,HEPES 0.0l mol/L),吹打均匀后加入2个底面积为25 cm2的培养瓶中,置37℃,5%CO2饱和湿度培养。视情况每2~3 d全量换液一次。当原代细胞融合并覆盖瓶底80%以上时,用0.25%胰蛋白酶消化,按1∶2比例传代培养。取第3代细胞与双相陶瓷生物活性骨复合培养。
1.4 双相陶瓷生物活性骨与MSCs的复合培养
1.4.1 MSCs在双相陶瓷生物活性骨上增殖的倒置相差显微镜观察及MTT法测定
分别将5 mm×5 mm×1 mm BCBB材料20块置于5块96孔培养板中预湿,每块板的A1、A2、A3、A4孔各放1块BCBB/BMP/bFGF材料。4 h后将密度为1×106/ml的第3代骨髓间充质干细胞20 μl接种于96孔培养板的预湿材料上,CO2培养箱中培养4 h,再分别加80 μl含15%新生牛血清的L-DMEM培养基继续培养,A9、A10、A11、A12孔单纯加相同培养基作为本底,每1 d换液一次。倒置相差显微镜观察。分别在第1、2、3、6、8 d时取出1块板加MTT10 μl,4 h后加三联液100 μl,12 h后用酶标检测仪在570 nm波长下测定各孔光密度(OD)值。根据细胞在材料上的增殖曲线确定最佳移植时机。
1.4.2 双相陶瓷生物活性骨与MSCs联合培养的SEM观察
将5 mm×5 mm×5 mm的双相陶瓷生物活性骨10块预湿后按1×106/ml浓度接种细胞,置培养皿中培养,第3、6 d分别取出材料各5块,用2.5%戊二醛固定15 min,干燥后于扫描电子显微镜观察细胞在材料上黏附、增殖情况。
2 结果
2.1 双相陶瓷生物活性骨的结构观察
镜下(SEM×100)可见BCBB孔内充满I型胶原、BMP及bFGF,可见I型胶原和BMP呈云絮状或网纱状,bFGF呈层片状(图1)。
2.2 MSCs体外培养的倒置相差显微镜观察
原代培养24 h时部分细胞开始贴壁伸展变形,刚贴壁的细胞单个排列,呈圆形或多角形,胞体透亮折光性强。48~72 h后呈纺锤形或梭形,每个细胞形成一个集落,增殖迅速,集落之间相互靠近。5 d后见贴壁生长的细胞数量明显增多,细胞形态出现较大变化,可见成纤维样细胞散布于培养瓶底,并有集落形成,细胞围绕中心呈漩涡状排列,随之集落逐渐增多、增大,并融合为单层。8 d时细胞基本长满瓶底,呈长梭形,有的细胞呈交叉重叠生长。原代细胞培养8~12 d后传代,传代细胞贴壁较快,刚传代时呈圆形,可见大量细胞悬浮,核透亮,2 h后少量细胞开始贴壁,细胞形态由圆形向梭形转化,之后可见细胞贴壁散在分布,贴壁细胞呈单层生长,伸展为梭形。第3代细胞形态为成纤维细胞样,细胞形态趋于一致,核分裂相多见,第5 d基本长满瓶底(图2),取此代细胞与材料复合。
2.3 双相陶瓷生物活性骨与MSCs联合培养的倒置相差显微镜观察
由于材料透光性差,倒置显微镜无法直接观察细胞在BCBB表面生长情况,可观察到贴附在BCBB孔隙边缘的MSCs,并见细胞贴附于培养板底生长。培养3 d的载体上可见有少量细胞生长,形态不规则;培养6 d的载体上细胞明显增多,有的细胞突起与其他胞体相连。
2.4 双相陶瓷生物活性骨与MSCs联合培养的SEM观察
在培养3 d的载体上可见有少量细胞生长,形态不规则,培养6 d的载体上细胞明显增多(图3),可见少数细胞变圆,为处于分裂期细胞,多数细胞呈长梭形,随材料表面特征成一定方向排列。细胞表面有多个细长突起,细胞突起交互连接呈网状,有的与其他胞体相连。
2.5 双相陶瓷生物活性骨与MSCs联合培养的MTT法测定
第1,2,3,6,8 d时取出一块板加MTT进行OD值测定,细胞在材料上增殖的OD值如表所示(表1),用联合培养组OD值减去本底的OD值,根据所得结果制出增殖曲线。MSCs的生长曲线呈S形,传代接种后第1~3 d细胞增殖缓慢为潜伏适应期,此期主要为MSCs的贴壁生长阶段。从第4 d开始细胞增殖加速,细胞曲线显示此阶段细胞数目呈指数级递增,此期为MSCs的对数生长期。第6 d达到顶点后,细胞不再增殖,生长活动停滞, MSCs生长进入一个平台期。之后,细胞数量轻度下降。第6 d时,MSCs载体联合培养细胞增殖达稳定期,此时为移植的最佳时机(图4)。表1 细胞在材料上增殖的OD值
3 讨论
评价材料生物相容性的方法主要有两种:一种是体内直接植入法,即将材料植入体内,不同时间段取出作大体和组织学检查;另一种是体外复合细胞培养法,即将材料与细胞进行体外培养,检测细胞的增殖与功能情况。体外复合细胞培养法是近年来采用的主要方法。它对材料毒性敏感性高、重复性好,简便、易行、快速、易于控制实验条件[3]。该实验用BCBB为支架,用免疫原性低、生物相容性好、支持成骨细胞黏附分化的I型胶原修饰BCBB表面[4],并复合以促进成骨细胞、成软骨细胞分化增殖的BMP和bFGF[2],制成双相陶瓷生物活性骨。扫描电镜观察到I型胶原、BMP、bFGF有效地复合到了双相陶瓷生物骨(BCBB)上,制得双相陶瓷生物活性骨,将其与MSCs复合培养。 图1镜下可见BCBB孔内充满I型胶原、BMP及bFGF(SEM×l00)
图4BMSCs与双相陶瓷生物活性骨联合培养的细胞增殖曲线 MSCs体外长期培养往往存在细胞老化及生物学功能退变等问题[5]。在该实验中,MSCs经3次传代体外培养不断纯化后获得的MSCs其纯度较高、增殖生长能力强。因此作者选择取第3代细胞与双相陶瓷生物活性骨复合培养。
MSCs的数量及密度直接影响其增生和分化。目前国内外报道MSCs在支架材料上的移植浓度多为5×105~7.5×106个/ml[5],本研究将浓度为1×106/ml的MSCs种植于双相陶瓷生物活性骨上,在体外进行三维立体培养,用二甲基四氮唑盐微量酶反应比色法(MTT法)测定细胞与材料联合培养时增殖达稳定状态的时间,通过测定OD值间接反映细胞生长及增殖活性[6]。根据增殖曲线变化确定第6 d时细胞在材料表面形成致密细胞层,可见细胞突起交错,细胞在材料表面生长状态良好,细胞增殖达稳定状态。表明该双相陶瓷生物活性骨具有良好的细胞黏附性和细胞相容性。
总之,MSCs能在双相陶瓷生物活性骨(BCBB/BMP/bFGF)表面黏附生长、增殖,双相陶瓷生物活性骨具有较好的细胞相容性。第6 d时,MSCs与双相陶瓷生物活性骨联合培养细胞增殖达稳定期,构建了理想的组织工程骨,表明MSCs与双相陶瓷生物活性骨联合培养构建组织工程骨是可行的。但是本实验尚属初步观察,还需要体内成骨定量、成血管和骨修复等进一步研究。
【文献】
[1] Xie C, Keynolds D, Awad H, et al. Structural bone allograft combined with genetically engineered mesenchymal stem cells as a novel platform for bone tissue engineering[J]. Tissue Eng,2007,13:435-445.
[2] Divya P, Sreerekha PR, Krishnan LK, et al. Growth factors upregulate deposition and remodeling of ECM by endothelial cells cultured for tissue-engineering applications[J]. Biomol Eng,2007,24:593-602.
[3] Wang H, Li Y, Zuo Y, et al. Biocompatibility and osteogenesis of biomimetic nano-hydroxyapatite/polyamide composite scaffolds for bone tissue engineering[J]. Biomaterials,2007, 28:3338-3348.
[4] Catherine D, Andres J, et al. Alpha-2beta-1 integrin-specific collagen-mimetic surfaces supporting osteoblastic differentiation[J]. J Biomed Mater Res, 2004, 69: 591-600.
[5] Siddappa R, Femandes H, Liu J, et al. The response of human mesenchymal stem cells to osteogenic signals and its impact on bone tissue engineering[J]. Curr Stem Cell Res Ther,2007:209-220.
[6] Jiao S. Diferetal cytotoxic sensitivity among MTT, NR and Alpase activity assays in human pulp cells exposed to dental resin monomers[J].Chinese Journal of Biomedical Enginerring, 1998,7:37-46.