益肾汤对实验性IgA肾病模型小鼠肾组织转化生长因子β1表达的影响
作者:万启军,何永成,石成钢,洪国保,胡斌,栾韶东
【摘要】 【目的】观察益肾汤对实验性IgA肾病(IgAN)模型小鼠肾组织转化生长因子β1(TGF?β1)表达的影响。【方法】选用BALB/c小鼠,采用口服牛血清白蛋白联合尾静脉注射葡萄球菌肠毒素B方法复制小鼠IgAN模型,抽样检测造模小鼠24h尿蛋白定量、肾组织过碘酸雪夫反应(PAS)染色及免疫荧光检查,确定造模成功后随机分为模型组,益肾汤高、低剂量组(剂量分别为0?1、0?05g·kg-1·d-1),并设正常对照组;采用荧光定量聚合酶链反应(FQ?PCR)法检测各组小鼠肾组织TGF?β1mRNA表达,免疫组化法检测各组肾组织TGF?β1含量。【结果】模型组肾组织TGF?β1mRNA表达及TGF?β1含量均显著升高(P<0?05);益肾汤高、低剂量组肾组织TGF?β1mRNA表达及TGF?β1含量均显著降低(P<0?05)。【结论】益肾汤IgAN的作用与抑制肾组织中TGF?β1的分泌及其mRNA表达有关。
【关键词】 益肾汤/药;IgA肾病/中药疗法;肾/病理学;转化生长因子β;疾病模型,动物;小鼠
研究证实细胞因子在IgA肾病(IgAN)的发生过程中起重要作用,其中,转化生长因子β1(TGF?β1)是公认的最重要的致纤维化因子[1]。本研究观察了TGF?β1在实验性IgAN小鼠肾组织中表达的特点及中药方剂益肾汤对TGF?β1的影响,现报道如下。
1材料与方法
1?1益肾汤组方及制备益肾汤组成:黄芪15g、生地20g、牡丹皮10g、熟地15g、赤芍10g、当归10g、山药15g、茯苓15g、山茱萸15g、金樱子15g、枸杞子15g、白茅根30g、女贞子15g、旱莲草15g、仙鹤草20g。按照“人—鼠用药剂量转换公式”,浓缩成高浓度(相当于成人剂量的2倍)及低浓度(相当于成人的每日用量)2种剂型,原液装瓶,高压消毒后密封保存,备用。
1?2实验动物BALB/c小鼠60只,鼠龄8~10周,体质量18~22g,雌性。由中山大学实验动物中心提供,动物许可证:SCXK(粤)2004?0011,动物批号:NO?0018045,粤监证字:2006A003。
1?3主要试剂与仪器牛血清白蛋白(BSA)由深圳晶美生物有限公司提供,批号:RF101?010;POINT GV20 (BAIHUI);POINT SP6 (SANYINJIAO)葡萄球菌肠毒素B(SEB)由军事医学院微生物流行病研究所提供;Trizol试剂(Invitrogen公司);Primer express 2?0 软件(美国Applied Bio?system Inc.);PE 9600型PCR仪(美国Perkin Elmer公司);逆转录聚合酶链反应(RT?PCR)试剂盒(德国QIAGEN 公司);脱氧核糖核苷酸(dNTPs)(10mmol/L,华美公司);PE 7000型荧光定量仪(美国Perkin Elmer公司);PCR buffer(美国ABI公司);dNTPs (25mmol/L,Sigma公司) ;荧光探针(10pmol/μL,上海生工);Taq 酶(美国ABI公司);德国KONTRON IBAS 2?5全自动图像分析系统。
1?4造模与分组按[2]方法复制小鼠IgAN模型:隔日灌服200mg/kgBSA,6周后按20mg/kg每日1次定期尾静脉注射BSA连续3d。8周时按0?5mg/kg尾静脉注射SEB,每周1次,连续3周,观察至12周末。造模第5周末,抽样检测造模小鼠24h尿蛋白定量、肾组织过碘酸雪夫反应(PAS)染色及免疫荧光检查,并与正常小鼠对照,确定IgAN模型成功后,随机分为模型组,益肾汤高、低剂量组,并设正常对照组;益肾汤高、低剂量分别以0?1、0?05g·kg-1·d-1剂量灌胃给药,模型组、正常对照组灌服等容积蒸馏水,每日1次,均连续7周。
1?5荧光定量聚合酶链反应法(FQ?PCR)检测各组小鼠肾组织TGF?β1mRNA的表达
1?5?1肾组织RNA的提取取肾组织块(约100mg)置匀浆器,加Trizol1mL,冷冻匀浆,转置于1?5mLEppendorf 管,加入氯仿0?2mL,盖紧盖子,用力摇动15s,15℃~30℃孵育2~3min,4℃、12 000r/min离心15min;取上清液至另一个1?5mLEppendorf管,加与上清液等容积的异丙醇,15℃~30℃孵育样品10min,4℃、12 000r/min离心10min;弃上清液,体积分数75%乙醇洗涤沉淀1次,4℃、7 500r/min离心5min;弃乙醇,空气或真空干燥5~10min(不要完全干燥),加焦碳酸二乙酯水(DEPC)溶解RNA,-80℃保存备用。若长期保存,加入2?5倍容积乙醇,置-80℃保存。
1?5?2引物的设计和合成采用ABI 3900台式高通量DNA合成仪合成。引物和探针由中山大学达安基因诊断中心合成并纯化。序列如下:TGF?β1:Forward Primer:5’?CGGAATACAGGGCTTTCGATT?3’;Reverse Primer:5’?GCTGATCCCGTTGATTTCCA?3’;TaqMan Probe:5’?FAM?AGCGCTCACTGCTCTTGTGACA?TAMRA?3’。GAPDH(内参照基因):Forward Primer:5’?TGTGTCCGTCGTG GATCTGA?3’;Reverse Primer:5’?TGCCTGCTT CACCACCTTCT?3’;TaqMan Probe:5’?FAM?TGCCGCCTGGAGAAACCTG CC?TAMRA?3’。
1?5?3逆转录反应取4μLRNA模板做逆转录反应,反应体系如下:5倍逆转录buffer4μL[逆转录buffer成分为50mmol/L Tris HCl(pH8?0)、50mmol/L KCl、4mmol/L MgCl2、10mmol/L二硫苏糖醇(DTT)],上游引物(10pmol/μL)0?4μL,下游引物(10pmol/μL)0?4μL,dNTPs(10mmol/L)0?5μL,MMLV反转录酶(200U/μL)1μL,DEPC9?7μL,RNA模板4μL,总体积为20μL。反应条件:37℃、1h,然后95℃、3min。
1?5?4荧光定量PCR反应以下反应均由PCR扩增仪扩增完成。反应体积为50μL,反应体系:5倍定量PCR buffer 10μL,上游引物F(10pmol/μL)1μL,下游引物R(10pmol/μL)1μL,dNTPs 0?5μL,荧光探针1μL,Taq 酶1?5μL,互补DNA(cDNA)5μL,重蒸水(ddH2O)30μL[PCR buffer成分为10mmol/L Tris?HCl(pH8?0)、50mmol/L KCl、2mmol/L MgCl2]。反应条件:93℃、2min,93℃、45s, 55℃、45s,共40个循环。
1?6免疫组化法检测各组小鼠肾组织TGF?β1含量采用免疫组化链霉亲和素—生物素过氧化物酶复合物(SABC)法。取免疫组化的肾组织切片,置于显微镜下,计数10个肾小球,光学放大400倍,图像经全自动图像分析系统处理,应用阳性单位(positive unit,PU)的计算公式计算阳性单位的数值,以各组的PU值进行比较。pPU=100%×(Ga-GA)/[(1-Aa)×Gmax]。注:Ga为阳性反应的平均灰度级;GA为整个视野的平均灰度;Aa为阳性反应的面积密度;Gmax为设定的灰度最高级(所用的是256),所有数据均由系统自动算出。
1?7统计学方法采用SPSS 11?0统计软件进行统计分析。
2结果
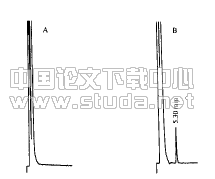
2?1IgAN动物模型模型组小鼠尾静脉注射SEB后,死亡2只小鼠,其他小鼠均有不同程度的神态萎靡、皮毛蓬乱、反应性下降、食量减少等现象;而正常对照组小鼠活动度、反应性、进食量等均未见明显异常。模型组抽样测定小鼠24h尿蛋白定量为(11?72±4?42)mg/d,显著高于正常对照组的(5?54±1?46)mg/d(P <0?01)。光镜见模型组小鼠肾小球体积轻度增大,系膜细胞和基质中、重度增生,部分肾小球囊腔粘连,肾小球毛细血管管腔挤压变窄,而正常对照组小鼠肾小球未见明显异常(图1);免疫荧光检查结果显示模型组小鼠系膜区IgA+++,而正常对照组小鼠系膜区IgA-~±(图2)。
2?2肾组织TGF?β1含量的测定由表1可见,模型组小鼠肾组织TGF?β1含量显著高于正常对照组(P<0?05);益肾汤高、低剂量组小鼠肾组织TGF?β1含量均显著低于模型组(P<0?05);益肾汤高、低剂量组小鼠之间肾组织TGF?β1含量无显著性差异(P>0?05)。各组小鼠肾组织TGF?β1表达见图3:正常对照组有少量TGF?β1表达;模型组TGF?β1表达明显增强;益肾汤高、低剂量组TGF?β1表达减弱。表1各组小鼠肾组织TGF?β1 阳性表达单位值比较
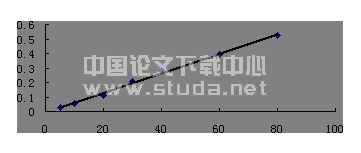
2?3TGF?β1 mRNA表达结果TGF?β1 mRNA标准扩增曲线见图4;TGF?β1 mRNA标准曲线直线回归见图5;各样本TGF?β1荧光扩增曲线见图6;各组肾组织TGF?β1 mRNA表达的差异见表2。表2结果显示模型组小鼠肾组织TGF?β1 mRNA的表达显著高于正常对照组(P<0?05);益肾汤高、低剂量组小鼠肾组织TGF?β1 mRNA的表达均显著低于模型组(P<0?05);两个益肾汤组小鼠之间肾组织TGF?β1 mRNA的表达无显著性差异(P>0?05)。图5为小鼠TGF?β1荧光定量标准回归曲线图,横坐标为起始拷贝数的对数,纵坐标为阈循环数nCt,相关系数r=0?998 6。线性关系良好,证实了nCt值进行定量的准确性。通过荧光定量PCR的扩增得知样本的nCt值,即可从该标准回归曲线上出该样本的起始拷贝数。 表2各组小鼠肾组织TGF?β1 mRNA定量表达比较
3讨论
IgAN是目前公认的发病率最高的原发性肾小球疾病,其主要病理特点是:肾脏系膜细胞和系膜基质增生[3]。IgAN系膜细胞和基质增生是多种因素综合作用的结果,多种细胞因子的作用与IgAN的发生和进展有关[4]。TGF?β1作为一种多功能的细胞因子,通过细胞表面复杂的受体信号传导途径调控细胞的增殖、分化和凋亡[1],特别在调控细胞外基质聚积(ECM)的过程中起中心调节作用,其主要机制有: (1)增加ECM的合成;(2)增加蛋白酶抑制因子的合成,减少ECM的降解;(3)增强细胞表面与ECM结合的受体—整合素的表达。近年来研究发现TGF?β1在IgAN的发生、中均有十分重要的作用,IgAN的血尿可能是因为链球菌感染后通过增加TGF?β1合成从而刺激IgA产生并最终导致IgAN的发生[5];在IgAN的进展过程中肾内肾素血管紧张素系统(RAS)和通过TGF?β1介导的早期纤维化密切相关[6]。FQ?PCR原理[7]:利用Taq酶对荧光双标记探针的切口平移效应,连续不断地检测反应体系中荧光信号的变化,当信号增强到某一阈值时,此时的循环阈值(nCt值)就被记录下来,该参数和PCR体系中起始DNA量的对数值之间有严格的线性关系,利用阳性梯度标准品的nCt值制成标准曲线,再根据样品的nCt值就可以准确定出起始DNA的数量。中医学认为IgAN属本虚标实之证,以肺、脾、肾三脏虚弱为本,外感、水湿、湿热、瘀血及湿浊为标[8]。研究表明[9],ECM聚积与中医的“血瘀”有密切的联系,益气、化瘀法是中医治疗肾小球疾病的常用治法,有确切的疗效。益肾汤是在古代名方六味地黄丸(《小儿药证直诀》)基础上,结合临床用药体会加减化裁而成。方中熟地甘柔补血、滋肾填精,当归补血活血;山茱萸、枸杞子、女贞子滋养肝肾固肾气,黄芪补气升阳,山药健脾益胃以助运化,茯苓渗利脾湿,牡丹皮凉泻肝火,生地、赤芍、白茅根清热凉血,金樱子固精,旱莲草滋阴,仙鹤草收敛。诸药合用,具有滋阴补肾固精、清热凉血活血之功效,主治肝肾阴虚之证。益肾汤组方中,多味中药均有益气、活血、化瘀之功效[10-11],因此,益肾汤治疗IgAN符合中医学及医学对IgAN病因、病理、病机的认识。已有临床验证益肾汤具有减少IgAN患者的蛋白尿、稳定患者肾功能的作用[12]。本实验结果显示,IgAN模型小鼠肾组织TGF?β1的分泌及其mRNA表达显著升高,提示TGF?β1参与了IgAN的发病过程,对IgAN模型所见的ECM增加有重要意义;益肾汤治疗组小鼠肾组织中TGF?β1的分泌及其mRNA表达较IgAN模型组显著减少,显示益肾汤可抑制IgAN肾组织中TGF?β1的表达、减少ECM的合成,进而延缓IgAN肾小球硬化的进展。
【】
[1]冯湛岚.TGF?β1与肾脏疾病的研究新进展[J].国外医学:泌尿系统分册,1999,19(6):280.
[2]刘志红,黎磊石,李莉.葡萄球菌肠毒素诱发的IgA肾病模型[J].中华肾脏病杂志,1989,5 (1):6.
[3]陈香美,谢院生.重视延缓IgA肾病进展的基础和临床研究[J].中华肾脏病杂志,2004,4(3):235.
[4]Yano N,Endoh M,Nomoto Y,et al.Phenotypic characterization of cytokine expression in patients with IgA nephropathy[J].J Clin Immunol Related,1997,17(5):396.
[5]Nishikawa Y,Shibata R,Ozono Y,et a1.Streptococcal M protein enhances TGF beta production and increase surface IgA?positive B cells in vitro in IgA nephropathy[J].Nephrol Dial Transplant,2000,15(6):772.
[6]Del Prete D,Gambaro G,Lupo A,et a1.Precocious activation of genes of the rennin?angiotensin system and the fibrogenic cascade in IgA glomerulonephritis[J].Kidney Int,2003,64(1):149.
[7]Holland P M,Abramson R D,Watson R,et al.Detection of specific polymerase chain reaction product by utilizing the 5’?3’exonuclease activity of thermos aquaticus DNA polymerase[J].Proc Natl Acad Sci USA,1991,88(16):7276.
[8]刘宏伟,庞俊娟.中医药治疗lgA肾病的临床探析[J].辽宁中医杂志,1998,25(4):158.
[9]陈香美,陈以平,李 平,等.1016例IgA肾病患者中医证候的多中心流行病学调查及相关因素分析[J].中西医结合杂志,2006,3(26):197.
[10]Yin X X,Zhang Y D,Wu H W,et a1.Protective effects of astragalus saponin I on early stage of diabetic nephropathy in rats[J].J Pharmacol Sci,2004,95(2):256.
[11]Ang N,Isbel N M,Nikolkrpaterson D J,et a1.Local macrophage proliferation in human glomerulonephritis[J].Kidney Int,1998,54:143.
[12]赵文景,张胜容,孙明霞.益肾汤配合西药治疗IgA肾病的临床观察[J].北京中医,2005,2(4):197.