人源胸腺素α原和白介素2融合蛋白的基因克隆与原核表达
【摘要】 目的 克隆人胸腺素α原/白介素2 融合基因,构建其原核表达载体并在大肠杆菌系统中有效表达。方法 采用RT?PCR方法,从人白血病细胞和人T淋巴细胞中分别扩增得到胸腺素α原/白介素2 基因,利用基因重组技术将融合基因片段重组于pET42a原核表达载体上,构建成pET42a?PI。经酶切、测序鉴定后,将重组质粒转化大肠杆菌Rosseta,IPTG诱导蛋白表达。表达产物经离子交换和分子筛纯化后进行Western blot分析,通过人外周血单核细胞玫瑰花结实验对融合蛋白进行了初步的活性测定。结果 凝胶电泳显示PCR产物的长度约750 bp,测序结果表明,扩增片段与预期序列一致。重组菌在IPTG诱导下表达相对分子质量为28 kDa的蛋白,纯化后的融合蛋白能提高人外周血单核细胞玫瑰花结形成率,表明具有一定活性。结论 成功克隆和构建了人胸腺素α原/白介素2融合基因的原核表达载体,并在原核表达系统中得到有效表达。
【关键词】 胸腺素α原;白介素2;融合蛋白;表达
Abstract:Objective To clone human prothymosin α and interleukin?2 fusion gene into the prokaryotic expression vector and to express the fusion protein effectively in E.coli system.Methods The human prothymosin α and interleukin?2 gene were amplified by RT?PCR from human leukemia cells and T lymphocytes respectively. The two genes were fused with a linker and the fusion gene fragment was used to construct a prokaryotic expression vector pET42a?PI by DNA recombinant technique. After identification by restriction analysis and DNA sequencing, the recombinant plasmid was transformed into E.coli Rosetta. The overexpressed protein induced by IPTG was purified by anion exchange chromatography and Sephacryl S?200 chromatography. The biological activity of the fusion protein was assayed using T cell E?rosette formation test of human blood. Results The PCR product was about 750 bp in length, which was consistent with the expected size of the fusion gene. Plasmid pET42a?PI was transformed into Rosetta and a new protein with a relative molecular weight of 28 kDa was expressed. The purified fusion protein could increase the E?rosette formation rate of human peripheral mononuclear cells.Conclusion The encoding sequence of human prothymosin α and interleukin?2 fusion gene was successfully cloned into the prokaryotical expression vector pET42a and can be expressed effectively in E.coli system.
Key words:prothymosin α; interleukin 2; fusion protein; expression
人源胸腺素α原(prothymosinα,proTα)是由109个氨基酸组成的一种小分子酸性蛋白。它具有多种不同的生物学活性,主要是促进细胞增殖和具有免疫调节剂的作用[1-3]。胸腺素α原作为细胞外信号蛋白,对细胞凋亡起调节作用,在细胞凋亡抑制剂的协同下可预防脑部中风[4]。Skopeliti等[5]在外周血单核细胞的培养过程中加入proTα,培养液中检测到IL?1及其受体、hsp90等多种蛋白的过度表达,而产生的IL?1可激活T细胞受体而促进T细胞增殖和IL?2的产生。人白细胞介素2 (Interleukin2, IL?2) 是由133个氨基酸组成的多肽。Burchill[6]等人研究发现IL?2和IL?2R(IL?2受体)主要是调整T细胞生长和维持T细胞的稳定。IL?2可缩短脑脊髓炎自身免疫过程并增强荷瘤鼠的免疫调节作用,对因移植性或化学方法诱发的肿瘤产生效果[7]。IL?2还能提高NK细胞(杀伤细胞)和LAK细胞(淋巴因子激活的杀伤细胞)的活性,可以用于治疗癌症,但是过度使用IL?2会带来不良反应。IL?2和 proTα协同作用于自体肿瘤的反应比单独使用IL?2所引起的反应要强[8,9]。IL?2和proTα的联合使用不仅能降低单独使用IL?2产生的毒副作用,而且还能够提高抗肿瘤的效果[8,10]。因此,本研究将IL?2和proTα进行融合,并引入柔性连接肽Linker,构建了proTα/IL?2融合蛋白的原核表达载体pET42a?PI,并在大肠杆菌系统中得到了有效表达,为进一步研究该融合蛋白的功能奠定基础。
1 材料与方法
1.1 材料
菌种Rosetta(DE3)、载体pET42a由本实验室保存。RNA提取试剂盒:Qiagen公司,RT?PCR试剂盒、限制性内切酶Nde I和Xho I、T4DNA连接酶、DNA Fragment Quick Purification/Recover Kit购自大连宝生物公司,HRP兔抗羊酶标二抗购自Sigma公司,人HL?60白血病细胞购自中山大学,HitrapTM Q阴离子交换柱、Sephacryl S?200购自安玛西亚公司,其他试剂均是进口或国产的分析纯试剂。
1.2 方法
1.2.1 引物设计
将白介素2融合于胸腺素α原的羧基端,为保持两者的活性,在两者之间放入一段连接肽,连接肽的组成:S?G?G?G?G?S。proTα基因的克隆:上游引物:P1:5′?CCAGGATCCCATATGTCA GACGCAGCCGTAG?3′;下游引物:P2:5′?ACTAAG CTTTTAGTCATCCTCGTCGGTCTTC?3′。IL?2基因的克隆:上游引物:P3:5′?GTCGGATCCATGGCACCT ACTTCAAGTTCTACAAAGAA?3′;下游引物:P4:5′?CCAGGCTCGAGTTAAGTTAGTGTTGAGATGATGC TTTG?3′。proTα/IL?2融合基因的克隆:上游引物:P5:5′?TTCTTTGTAGAACTTGAAGTAGGTGCAGAG CCACCGCCACCCGAGTCATCCTCGTCGGTCTTCT?3′,下游引物:P6:5′?AGAAGACCGACGAGGATGAC TCGGGTGGCGGTGGCTCTGCACCTACTTCAAGTT CTACAAAGAA?3′。其中,引物P1和P4分别引入了限制性酶切位点Nde I和Xho I。
1.2.2 目的基因的PCR扩增
用引物P1和P2从人HL?60白血病细胞中进行RT?PCR克隆出proTα基因;用引物P3和P4从人T淋巴细胞中进行RT?PCR克隆出IL?2基因;以IL?2 DNA片段为模板,用引物P3和P5进行PCR,获得linker?IL?2;以proTαDNA片段为模板,用引物P4和P6进行PCR,获得linker?proTα;用linker?IL?2和linker?proTαDNA片段以 1∶1混合作为模板,用引物 P1 和P6进行PCR,扩增出融合基因proTα?linker?IL?2 DNA片段(PI)。每步PCR都包含相应的模板和上下游引物、Tag聚合酶、dNTPs ,PCR仪设定的扩增条件:先在94 ℃变性5 min ,再于94 ℃1 min,58 ℃1 min ,72 ℃1 min 进行30个循环,最后于72 ℃延伸10 min,PCR结束后,取1 μL反应液进行10 g/L琼脂糖凝胶电泳检测PCR结果。PCR 产物用低熔点琼脂糖凝胶电泳分离后,DNA回收试剂盒回收纯化。
1.2.3 重组质粒pET42a?PI的构建及鉴定
用限制性内切酶Nde I、Xho I对经试剂盒纯化后的PCR产物和表达载体pET42a进行双酶切,酶切完毕,10 g/L琼脂糖凝胶电泳,切下胶中所需片段,以DNA Fragment Quick Purification/Recover Kit回收。酶切后的PCR产物与回收后的载体用T4DNA连接酶连接。连接产物转化大肠杆菌Rosseta,将重组菌Rosseta/pET42a?PI涂布于含有35 μg/mL氯霉素和100 μg/mL 卡那霉素的LB琼脂平板,挑取阳性单克隆,置含相应抗生素的LB培养液的试管中37 ℃振摇过夜,用碱裂解法小量制备质粒DNA,获取的质粒分别用Nde I和Xho I单、双酶切,10 g/L琼脂糖凝胶电泳鉴定,质粒进行DNA测序鉴定。
1.2.4 融合蛋白的诱导表达
将鉴定正确的阳性克隆菌株Rosseta/pET42a?PI,接种到含有35 μg/mL氯霉素和100 μg/mL 卡那霉素的5 mL LB 培养基中,在37 ℃ 以180 r/min 培养过夜,以1∶50 比例接种至含相应抗生素的50 mL LB 中,在37 ℃,180 r/min 条件下培养至A600 为0.4~0.5,用终浓度为1 mmol/L 的IPTG 诱导蛋白表达。之后在同等条件下继续培养4 h。取适量菌液在4 ℃条件下,5 000 r/min 条件下离心5 min,菌体沉淀用1 mL 细菌裂解液(50 mmol/L Tris?HCl,pH=7.2,50 mmol/L NaCl)重悬。重悬液用超声法破碎细胞,裂解菌体再在13 000 r/min 条件下离心5 min。分别取菌体裂解上清液(可溶蛋白部分)和沉淀重悬液(不可溶蛋白部分)各10 μL,SDS?PAGE电泳分析蛋白表达情况。
1.2.5 融合蛋白的纯化
菌体经超声破碎后,4 ℃,13 000 r/ min,离心10 min,取上清,用0.22 μm低蛋白吸附的滤器过滤后上样。经阴离子交换柱粗纯(平衡缓冲液50 mmol/L Tris?HCl,pH7.5,10 mmol/L NaCl;洗脱缓冲液50 mmol/L Tris?HCl,pH7.5,500 mmol/L NaCl),洗脱峰再过Sephacryl S?200分子筛(20 mmol/L Tris?HCl,150 mmol/L NaCl,pH7.5),收集洗脱峰并进行SDS?PAGE电泳分析。
1.2.6 融合蛋白的Western blot分析
纯化后的融合蛋白样品,用SDS?PAGE分析,将凝胶上的蛋白转移至硝酸纤维素膜,30 V过夜。用封闭液[含5%脱脂奶粉的TBST(20 mmol/L Tris?HCl,pH7.5,500 mmol/L NaCl,0.05% Tween?20)]室温封闭1 h,TBST洗膜3次,每次10 min,加入羊抗IL?2单克隆抗体,室温孵育1 h。重复洗膜3次,加入辣根过氧化物酶标记的兔抗羊IgG,室温作用1 h,再洗膜3次,加入DAB显色液,室温静置,用蒸馏水终止反应。
1.2.7 融合蛋白活性初步鉴定
按常规方法用淋巴分离液分离健康人外周血单核细胞,1 %台盼蓝染色计数细胞。用含血清的培养液调整细胞数至2×106个/mL。各取细胞液100 μL入试管,分为生理盐水组及不同浓度的纯化蛋白组:1×10-7 、1 ×10-8、1 ×10-9mol/L 组,37 ℃水浴90 min;用生理盐水洗涤绵羊红细胞,将细胞数调整至2×108个/mL;在每支试管中加入绵羊红细胞100 μL,在4 ℃放置2~3 h;涂片,染色,于高倍镜下计数200个淋巴细胞中形成玫瑰花结的细胞数(结合3个及3个以上绵羊红细胞),玫瑰花形成细胞的百分数。
2 结 果
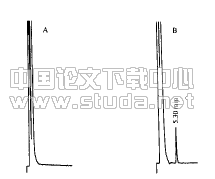
2.1 PI基因的RT?PCR结果及克隆载体的构建与鉴定 以特异性引物经PCR扩增后,PCR产物经1%的琼脂糖凝胶电泳分析,获得约750 bp大小的DNA片段(如图1),产物回收后进行Xho I和Nde I双酶切并连入原核表达载体pET42a中,形成重组表达质粒pET42a?PI,转化大肠杆菌Rosseta,挑取阳性克隆抽提质粒,分别用Xho I、Nde I进行单、双酶切,酶切结果如图2,双酶切片断与预期片断大小一致,测序结果与预期序列一致。
2.3 融合蛋白的表达
重组菌Rosseta/ pET42a?PI在1 mmol/L IPTG 37 ℃条件下诱导表达4 h,菌体经超声波破碎,SDS?PAGE电泳结果显示,在分子量为28 kDa 处有蛋白过量表达,与预期的融合蛋白大小一致(如图3),且融合蛋白以可溶形式存在。
2. 4 融合蛋白的纯化
可溶性融合蛋白采用HitrapTM Q阴离子交换柱和Sephacryl S?200分子筛纯化(图4)后,洗脱峰经SDS?PAGE电泳分析,蛋白纯度可达95%以上(图5)。纯化的融合蛋白经Western blot分析,在杂交膜上出现了明显的单一条带,分子量约为28 kDa(图6)。
2.6 E玫瑰花结实验
将纯化的融合蛋白稀释成不同的浓度,分别加到人外周血单核细胞悬液中与绵羊红细胞一起温育,与对照相比,可以明显提高淋巴细胞玫瑰花结形成率,结果见表1。这表明大肠杆菌表达的融合蛋白具有一定的活性。表1 融合蛋白对人外周血单核细胞E玫瑰花结形成率的影响(略)
3 讨 论
本实验使用的菌株为Rosetta(DE3)菌株,它是经过修饰后专用于带有大肠杆菌稀有密码子的原核蛋白表达的菌株。多数氨基酸有不止一个密码子,而不同的生物使用这61个密码子的偏爱性不同,对大肠杆菌密码子应用情况的分析表明,一些密码子很少使用,尤其是Arg密码子AGA,AGG,CGG,CGA,Ile密码子CUA,Gly密码子GGA和Pro密码子CCC很少被用到。ProT α/IL?2融合蛋白基因中共有13个稀有密码子,而且还有3个密码子连续出现,这会影响融合蛋白在大肠杆菌中的表达。事实证明,proT α/IL?2融合基因在选用BL21作为宿主菌时,根本检测不到目的蛋白。基于这种情况,本实验从众多的宿主菌中挑选Rosetta作为表达菌,获得了该融合蛋白的可溶性表达。Rosetta菌株还能够由一种氯霉素抗性的、与pET相容的质粒提供AUA,AGG,AGA,CUA,CCC和GGA的tRNA,所以这类菌株能够明显改善大肠杆菌中由于稀有密码子造成的表达限制。在proT α/IL?2融合蛋白基因构建中,为了使表达的两种细胞因子的空间构象尽量与天然产物相近,以保持其最大的生物学活性,本实验在引物中设计了6个亲水性和低电荷效应的氨基酸序列作为接头(4个Gly、2个Ser),因为甘氨酸结构简单,对融合蛋白的立体构象影响较小。
综合以上,本实验成功地利用PCR方法扩增了人IL?2/proTα融合基因,将其克隆到原核表达载体pET42a上,并转化大肠杆菌Rosetta,通过IPTG诱导成功表达并纯化获得了IL?2/proTα融合蛋白。玫瑰花结实验表明,纯化后的融合蛋白具有一定的生物学活性。本研究为进一步研究该融合蛋白的生物学活性奠定了一定基础。
【】
[1]BUTERA S T, PISELL T L, LIMPAKARNJANARAT K, et al. Production of a novel viral suppressive activity associated with resistance to infection among female sex workers exposed to HIV type 1 [J]. AIDS Res Hum Retrovir, 2001,17(8):735-744.
[2]CHANG T L, MOSOIAN A, PINE R, et al. A soluble factor secreted from CD8+ T lymphocytes inhibits human immunodeficiency virus type 1 replication through STAT1 activation[J]. J Virol, 2002,76(2):569-581.
[3]COCCHI F, DEVICO A L, GARZINO?DEMO A, et al. Identification of RANTES, MIP?1a and MIP?1b as the major HIV?suppressive factors produced by CD8+ T cells[J]. Science,1995,270(5243):1811?1815.
[4]UEDA H, FUJITA R, YOSHIDA A, et al. Identification of prothymosin?alpha1, the necrosis apoptosis switch molecule in cortical neuronal cultures[J].J Cell Biol,2007,176(6):853?862.
[5]SKOPELITI M, KRATZER U, ALTENBEREND F, et al. Proteomic exploitation on prothymosin alpha induced mononuclear cell activation[J]. Proteomics, 2007,7(11):1814?1824.
[6]BURCHILL M A, YANG J, VANG K B, et al. Interleukin?2 receptor signaling in regulatory T cell development and homeostasis[J]. Immunol Lett,2007,114(1):1?8.
[7]MONTERO E, ALONSO L, PEREZ R, et al. Inter?leukin?2 mastering regulation in cancer and autoimmunity[J]. Ann NY Acad Sci, 2007,1107:239?250.
[8]VOUTSAS I F, BAXEVANIS C N, GRITZAPIS A D, et al. Synergy between interleukin?2 and prothymosin alpha for the increased generation of cytotoxic T lymphocytes against autologous human carcinomas[J].Cancer Immunol Immunother,2000,49(8):449?458.
[9]ECKERT K, GRUNBERG E, IMMENSCHUH P, et al. Interleukin2 activated killer cell activity in colorectal tumor patients: evaluation of in vitro effects by prothymosin alpha1[J]. Cancer Res Clin Oncol, 1997,123(8):420-428.
[10]LOPEZ?RODRI J L, CORDERO O J, SARANDESES C. Interleukin?2 killer cells: in vitro evaluation of combination with prothymosin alpha[J]. Lymphokine Cytokine Res, 1994,13(3):175-182.