实时荧光PCR和RT-PCR方法检测登革病毒的比较研究
作者:刘建军,古丽巴哈尔,阳 帆,陈家敏,何雅青,杨 洪
【摘要】 目的 通过2种检测登革病毒方法的比较,以提高检测登革病毒的灵敏度和特异性。方法 利用Taqman MGB技术,根据登革病毒3′端非编码区的一段高度保守序列,设计登革1~4型荧光PCR通用引物和TaqmanMGB探针,以登革热毒株作为标准,以乙脑毒株作对照,建立实时荧光PCR检测登革病毒的快速方法。并对10份ELISA法检测阳性的临床血清标本进行RT-PCR及荧光PCR扩增。结果 RT-PCR检测10份临床血清标本,2份阳性,阳性率为20%。实时荧光PCR检测登革病毒与乙脑病毒无交叉反应,检测10份临床血清标本,5份阳性,阳性率为50%。从RNA提取到检测结果仅需4h。结论 Taqman MGB实时PCR检测方法快速、敏感性高、特异性强,可作为登革病毒的快速检测方法,应用于登革热的临床早期诊断。
【关键词】 登革病毒;RT-PCR;Taqman GMB实时PCR
【Abstract】 Objective In order to improve the sensitivity and specificity of detecting dengue viruses, two methods for detecting dengue viruses were compared.Methods Using Taqman MGB technique, a pair of universal primers and Taqman MGB probe were designed according to a highly reserved sequence of the 3′-noncoding region of dengue viruses type 1-4. Dengue virus strains were used as standard and Japanese encephalitis virus strains were used as control, the real-time PCR assay for specific and sensitive detection of the dengue viruses was established. While 10 serum specimens of ELISA positive were detected by the RT-PCR and fluorescent PCR.Results There was no cross-reaction with Japanese encephalitis virus. Of 10 specimens, 2 was positive by RT-PCR and 5 was positive by real-time PCR. The test could be completed in 4 hours.Conclusion The Taqman MGB real-time PCR assay was fast, sensitive and specific. It could be applied to the quick early diagnosis of dengue viruses.
【Abstract】 dengue virus;RT-PCR;Taqman GMB real-time PCR
登革热是流行于热带、亚热带地区的一种急性虫媒传染病,其病原体为登革病毒,近年来随着全球气候变暖和国际的增多,登革病毒感染呈扩大蔓延之势,发病率不断升高。由于缺乏疫苗和有效的防治措施,因此对该疾病实行早期诊断十分必要。
登革病毒属于黄病毒科黄病毒属, 为单股正链RNA病毒,基因组长约11kb。依抗原性不同分为1、2、3、4四个血清型(DEN1~4)[1,2]。登革病毒感染的实验室诊断,传统方法是从患者血清中分离病毒,或用血清学方法检测病毒的特异性抗体。但病毒分离费时,检测血清抗体需分别在患者感染的急性期及恢复期采集双份血清, 同时存在广泛的交叉反应而受到干扰[3],这些均不利于疾病的早期诊断。近年来国内外均有报道应用RT-PCR检测登革热病毒[4],但RT-PCR方法容易造成污染,同时也存在从临床血清标本中检测登革病毒敏感性不够的问题。这就需要建立一种更敏感、特异和快速的检测鉴定方法,以实现对登革热患者的早期快速诊断,为预防控制登革热的流行赢得时间。本研究比较了利用TaqmanMGB探针技术的实时荧光PCR和RT-PCR方法检测登革病毒特异性,以期选择特异性好、灵敏度高的检测方法,达到快速诊断登革热的目的。
1 材料与方法
1.1 毒株及血清标本 登革病毒1~4型标准株由广东省疾病预防控制中心提供,乙脑病毒疫苗株、乙脑病毒强毒株由成都生物制品所提供。血清标本采自深圳市近几年发病2周内的疑似登革热病人和发病10天内的疑似乙脑病人,-80℃保存。
1.2 主要试剂 病毒RNA提取试剂盒为Roche公司产品,TaqDNA聚合酶、PCRbuffer、MgCl2、随机引物购自Invitrogen公司,dNTP购自上海生工公司, AMV逆转录酶、RNaseinhibitor购自大连宝生物公司,引物和荧光探针由上海基康生物技术有限公司合成及标记,并用聚丙烯酰胺凝胶电泳纯化。
1.3 主要仪器设备 Centrifuge 5415D台式高速离心机购自德国Eppendorf公司, Ultrospec 2000紫外可见光蛋白核酸分析仪购自美国GE公司, 9700基因扩增仪购自美国ABI公司,Gene Genius凝胶成像分析系统购自英国Syngene公司, Mx4000荧光PCR仪购自美国Stratagene公司。
1.4 引物及探针设计 在GeneBank上检索登革病毒4个血清型中都一致的高度保守序列,根据登革病毒(DEN)聚合蛋白基因的一段高度保守序列,设计登革1~4型RT-PCR通用引物,扩增片段长度为511bp。根据DEN 3端非编码区的一段高度保守序列,设计登革1~4型荧光PCR通用引物和Taqman探针,探针5′用FAM报告荧光基团标记,3′用MGB淬灭荧光基团标记,扩增片段长度为68bp。
登革病毒RT-PCR通用引物:
Den-D1: 5′ TGAATATGCTGAAACGCGCGAGAAACCG 3′
Den-D2: 5′ TTGCACCAACAGTCAATGTCTTCAGGTTC 3′
登革病毒荧光PCR通用引物:
Den-FP: 5′ GCATATTGACGCTGGGAGAGA 3′
Den-RP: 5′GGCGTTCTGTGCCTGGAAT 3′
登革病毒通用探针:
Den-Probe:5′ FAMCAGAGATCCTGCTGTCTCMGB 3′
引物和探针均由上海基康生物技术有限公司合成及标记。
1.5 病毒RNA提取 1~4型登革病毒标准株用1640培养液溶解,接种C6/36细胞,传代次,按病毒RNA提取试剂盒说明书操作,提取病毒RNA,RNA置-80℃保存备用。
1.6 反转录及普通PCR
1.6.1 RNA逆转录 反应总体积为20μl,在反应管内依次加入:5×缓冲液5μl,2.5mmol/L 4×dNTP 1μl,0.3μg/μl Random(Invitrogen公司生产)引物1μl,提取的RNA 12μl,AMV逆转录酶(10u/μl)1μl混匀。反应条件为:42℃ 60min→95℃加热5min→4℃保存。然后将产物放置于-20℃备用。
1.6.2 PCR扩增 反应总体积为20μl,在反应管内依次加入:10×缓冲液2μl,2.5mmol/L,4×dNTP 1μl,25mmol/LMgCl2 2.5μl,通用引物D1、D2(5μmol/L)各1μl,RT产物0.5μl(Ⅰ型,Ⅱ型,Ⅳ型)、2μl(Ⅲ型,血清标本,阴性对照),Taq酶(5u/μl) 0.25μl,加H2O补足体系。反应条件为:94℃ 5min→94℃ 30s,60℃ 30s,72℃ 30s,循环40次→72℃延伸10min→4℃保存。
1.6.3 扩增产物电泳分析 配制含溴乙锭的1.5%琼脂糖凝胶,取10μlPCR产物电泳,在凝胶成像仪上观察并照相记录实验结果。
1.7 实时荧光PCR 反应总体积为25μl,在反应管内依次加入:10×缓冲液2μl,10mmol/L 4×dNTP 0.75μl,50mmol MgCl2/L 2.5μl,引物Den-FP,Den-RP(10μmol/L)各0.5μl,探针Den-probe(5μmol/L)0.6μl,RT产物0.5μl(Ⅰ型,Ⅱ型,Ⅳ型)、2μl(Ⅲ型,血清标本,阴性对照),Taq酶(5u/μl)0.25μl,加H2O补足25μl体系。反应条件是:50℃ 2min→95℃ 10min→95℃ 30s→60℃ 30s,循环40次→4℃保存。采用MX4000实时荧光PCR扩增仪进行扩增,延伸阶段检测荧光。
2 结果
2.1 普通RT-PCR检测结果 1~4型登革病毒标准株、10份发病2周内疑似登革病毒感染病人血清,其IgM、 IgG检测为阳性,乙脑病毒疫苗株、乙脑病毒强毒株进行RT-PCR检测,在511bp处1~4型登革病毒标准株都出现了目的基因条带,10份疑似登革病毒感染病人血清只有2份出现目的基因条带,其他标本都为阴性,见图1。说明此RT-PCR检测体系具有良好的特异性。
注: DNA分子质量标准;1~4分别为Ⅰ~Ⅳ型登革毒株;
5~13血清标本(其中5和8为同一标本);
14、15为乙脑病毒对照;-为空白对照
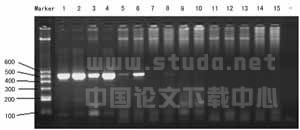
图1 登革Ⅰ~Ⅳ型毒株和血清标本PCR扩增结果
2.2 登革病毒Taqman MGB PCR体系检测结果
2.2.1 有效性检验 按1.7方法,分别提取登革病毒1~4标准株RNA,进行反转录的实时PCR,1~4型均观察到荧光信号增强。
2.2.2 特异性分析 登革病毒1~4标准株、乙脑病毒疫苗株、乙脑病毒强毒株经TaqmanMGB体系检测,只有登革病毒1~4标准株观察到荧光信号增加外,乙脑病毒疫苗株、乙脑病毒强毒株均没有荧光增加信号,见图2。这证明了此TaqmanMGB检测体系的特异性。
2.2.3 登革病毒TaqmanMGB PCR检测体系的应用 用Ⅱ型登革病毒作为阳性对照,对10份发病2周内疑似登革病毒感染病人血清,其IgM、 IgG检测为阳性,8份发病10天内疑似乙脑病毒感染病人血清作为对照,其IgM、 IgG检测为阳性。进行TaqmanMGB PCR检测,结果只有5份疑似登革病毒感染病人血清出现荧光信号增加,其他血清标本均无荧光信号。见图3。注:1、2、3、4分别为Ⅰ、Ⅱ、Ⅲ、Ⅳ登
革病毒标准株
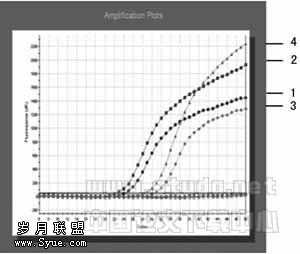
图2 登革病毒荧光PCR特异性分析
注:1:Ⅱ型登革病毒标准株;
2~6:疑似登革病毒感染病人血清标本
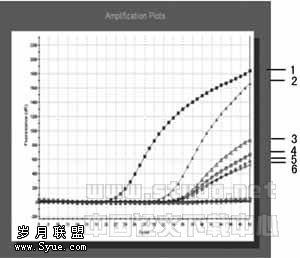
图3 血清标本荧光PCR检测结果
3 讨论
Taqman探针是一条与病原体核酸特异性结合的荧光素标记探针,它的结合位点位于普通PCR的2条引物之间[5]。探针的5′端和3′端分别标记报告荧光基团和淬灭荧光基团,PCR扩增在加入一对引物的同时加入荧光探针,探针完整时,报告基团发射的荧光信号被淬灭基团吸收。PCR扩增时, Taq酶发挥它的5′→3′的外切酶功能,将探针切成单核苷酸,5′端发出的荧光信号不再被3′端所吸收而能被仪器检测到。每扩增一条DNA链,就有一个荧光分子形成,实现了荧光信号的累积与PCR产物形成完全同步。因此,随着PCR产物的不断增加,仪器所检测到的荧光信号越来越强。当标本中不含病原体时,PCR反应不发生,不产生荧光信号,其扩增曲线为一水平线。
TaqmanMGB探针是在Taqman原理基础上提出的[6]。TaqmanMGB探针的突出优点是实验优化、步骤简单,提高了配对与非配对模板间的Tm值差异,由于在探针的3′端的淬灭基团为不发光的荧光基团,并且与报告基团在空间位置更接近,使杂交的稳定性和重复性大大提高,实验的结果更精确,分辨率更高。
笔者在TaqmanMGB技术基础上,建立了实时PCR检测1~4型登革病毒的方法。上述研究结果表明:(1)本检测方法可靠性好、敏感性高,比普通PCR方法灵敏度提高30%,可检测发病10天内的临床血清标本,而传统的登革病毒分离方法要求发病5天内的标本,才有可能分离出阳性。(2)特异性强,收集荧光在较高的退火温度(60℃)进行,排除了模板的非特异性扩增,同时,与容易造成血清学交叉反应的乙脑病毒及其临床标本都无交叉反应,可用于登革病毒特异性的实时PCR检测。(3)操作简单,结果观察直观明了,采用闭管检测和荧光技术,避免了普通PCR方法容易产生交叉污染而发生非特异性扩增的缺陷,并可防止病毒扩散及环境污染,以及强致癌物溴乙锭对操作人员的危害。(4)快速。传统的登革病毒分离方法耗时较长,至少需半个月,而本方法所需时间仅4h,比传统方法大为缩短,适用于登革病毒的快速准确的检测。
【】
1 肖维威,马文丽,郑文岭.登革病毒的基因组结构及其基因检测.中华检验医学杂志,2003,26(3):188-189.
2 Jelinek T. Dengue fever in international travelers. Clin Infec Dis,2000,31:144-147.
3 Schwartz E, Mileguir F, Grossman Z,et al. Evaluation of ELISA-based sero-diagnosis of dengue fever in travelers. J Clin Virol,2000,19(3):169-173.
4 Drosten C, Gottig S, Schilling S, et al. Rapid detection and quantification of RNA of ebola and marburg viruses, lassa virus, crimean-congo hemorrhagic fever virus, rift valley fever virus, dengue virus, and yellow fever virus by real-time reverse transcription-PCR. J Clin Microbiol,2002,40(7): 2323-2330.
5 Callahan JD, Wu SJ, Dion-Schultz A, et al. Development and evaluation of serotype-and group-specific fluorogenic reverse transcriptase PCR (TaqMan) assays for dengue virus. J Clin Microbiol,2001,39(11): 4119-4124.
6 Zhao JR, Bai YJ, Zhang QH, et al. Detection of hepatitis B virus DNA by real-time PCR using TaqMan-MGB probe technology. World J Gastroenterol,2005, 11(4):508-510.











