白藜芦醇通过线粒体途径减轻大鼠重症急性胰腺炎肺损伤
作者:沙焕臣,拉吉姆,马清涌,徐复国,马振华
【摘要】 目的: 探讨白藜芦醇(RES)对实验性重症急性胰腺炎(SAP)大鼠肺损伤的保护作用及其机制. 方法: 32只成年雄性SD大鼠随机分为假手术(SO)组;SAP组;地塞米松(DEX)组和RES组. 各组大鼠在制模后12 h采集标本. 动脉血气分析检测动脉血氧分压(PaO2);酶联免疫吸附试验(ELISA)测定血清TNF?α和IL?6含量;透射电镜(TEM)观察肺脏超微结构变化;RT?PCR检测凋亡调控基因Bax, Bcl?2和Caspase?3 mRNA表达;Western Blot检测凋亡调控蛋白Bax,Bcl?2,Caspase?3和线粒体内细胞色素c(Cyt c)表达. 结果: SO组,SAP组,RES组和DEX组PaO2水平分别为:(108.30±8.24),(76.34±5.18),(97.43±6.02),(92.50±5.97) mmHg,RES组和DEX组PaO2水平明显高于SAP组(P<0.05). TNF?α含量分别为:(12.54±0.75),(95.59±5.61),(61.66±3.33),(50.90±4.62) ng/L,RES组与SAP组相比较,差异有统计学意义(P<0.05). IL?6含量分别为:(9.29±1.75),(55.68±7.24),(32.29±3.98),(42.51±3.3) ng/L,RES组与SAP组相比较,IL?6含量明显降低(P<0.05). HE和TEM镜下观察结果显示,SAP组肺组织明显充血肿胀,并可见大量炎细胞浸润和细胞凋亡,线粒体肿胀明显;RES组肺组织病理损害程度较SAP组减轻;PCR结果显示,SAP组凋亡调控基因Bax, Caspase?3 mRNA表达较SO组明显升高,Bcl?2 mRNA表达降低,RES组Bcl?2 mRNA表达较SAP组升高(P<0.05),Bax, Caspase?3 mRNA表达较SO组明显降低,Western Blot 检测结果与PCR结果一致. 结论: RES可以通过线粒体途径抑制SAP大鼠肺组织细胞凋亡,从而起到改善肺脏损伤的作用.
【关键词】 急性胰腺炎;白藜芦醇;肺损伤
0引言
急性肺损伤(acute lung injury, ALI)是重症急性胰腺炎(severe acute pancreatitis, SAP)患者常见的早期并发症和主要死亡原因之一[1-2]. 目前对于SAP并发ALI的机制研究主要集中在炎症因子、细胞介质和微循环障碍等方面,认识ALI的发病机制以及如何采取有效措施进行预防和治疗,已成为各国学者竞相研究的热点问题. 有研究[3-4]显示,白藜芦醇(resveratrol, RES)具有治疗大鼠SAP肺损伤的作用. 但是有关RES缓解肺损伤作用机制的研究还少见报道. 本研究在成功建立大鼠SAP模型后,从调控细胞凋亡的线粒体通路入手,观察RES对大鼠肺脏损伤的保护作用以及其作用通路,探讨RES缓解SAP肺损伤的作用机制.
1材料和方法
1.1材料健康成年雄性SD大鼠32只,体质量250~300 g(西安大学动物中心提供);牛磺胆酸钠(美国Sigma公司);RES(西安奥塞斯生物有限公司);TNF?α,IL?6 ELISA检测试剂盒(深圳晶美生物工程有限公司);PCR试剂盒(大连宝生物工程有限公司);引物由上海生物工程技术服务有限公司合成;凋亡调控蛋白Bax,Bcl?2,Caspase?3,细胞色素c(Cytochrome c,Cyt c) mAb(美国Santa Cruz生物技术有限公司);辣根过氧化物酶标记的羊抗小鼠Ⅱ抗、小鼠抗β?actin mAb(北京博奥森生物技术有限公司);线粒体提取试剂盒(上海杰美生基因医药科技有限公司);增强化学发光剂 (美国Pierce生物技术有限公司);透射电镜(日本东芝公司).
1.2方法
1.2.1动物分组及SAP模型建立将32只大鼠随机分为假手术(SO)组、SAP组、RES治疗组和地塞米松(dexamethasone, DEX)组,每组动物8只. 大鼠禁食12 h,禁水4 h,25 g/L戊巴比妥钠(1.2 mg/kg)腹腔注射麻醉. 动脉夹夹闭胰胆管近端和远端,40 g/L牛磺胆酸钠(1 mL/kg)经胰胆管逆行注射建立SAP模型,注射时间保持1 min,拔出穿刺针,取出动脉夹. SO组仅于开腹翻动十二指肠后缝合腹壁,胰胆管内不注射任何药物;在建立SAP模型后,经阴茎背静脉RES组立即注射RES 10 mg/kg;DEX组立即注射DEX 0.5 mg/kg. 大鼠在制模后12 h剖杀取材.
1.2.2大鼠腹水计量和死亡率记录在取材前先打开大鼠腹壁,以10 mL无菌注射器收集大鼠腹水并计量. 大鼠死亡率方法为未到12 h死亡的大鼠从本组中排除,另选大鼠补齐,以死亡的大鼠数量和总计应用的大鼠数量比值计算大鼠死亡率.
1.2.3动脉血PaO2检测在大鼠剖杀前从腹主动脉取血0.5 mL,应用i?STAT全自动血气分析仪检测各组大鼠动脉血气分析.
1.2.4血浆TNF?α和IL?6 ELISA检测应用ELISA检测试剂盒检测大鼠血浆中TNF?α和IL?6含量,详细步骤严格按照试剂盒说明书进行操作.
1.2.5肺组织和胰腺组织的病观察肺组织和胰腺组织40 g/L多聚甲醛固定后,常规石蜡包埋切片,HE染色,光镜下观察胰腺组织病理学改变. 另取肺脏和胰腺组织1 mm×1 mm×1 mm以25 g/L戊二醛4℃固定8 h,梯度乙醇脱水,环氧树脂Epon812浸透,LKB?V型超薄切片机进行超薄切片(50~70 nm),电镜下观察肺和胰腺组织超微结构改变.
1.2.6肺组织总RNA提取及RT?PCR用Trizol试剂提取肺组织中的总RNA,测定260 nm/280 nm的A值,RNA浓度. 取RNA 2 μL,用RT试剂盒合成cDNA链. 再以逆转录反应液2 μL作为模板,PCR试剂盒进行扩增. PCR反应条件为:变性94℃ 30 s,退火55℃ 45 s,延伸72℃ 1 min,共30个循环;72℃延伸10 min终止反应. 扩增产物用15 g/L琼脂糖凝胶电泳,紫外凝胶成像系统摄影. 检测指标为凋亡调控基因Bax,Bcl?2和Caspase?3,以β?Actin作为内参照. Bax引物序列为:上游5′?TCCAGGATCGAGCAGA?3′,下游5′?AAGTAG AAGAG G GCA ACC?3′(256 bp);Bcl?2引物序列为:上游5′?CTGGTGGAC AA CA TC GC T CTG?3′,下游5′?GGTCTGCTG ACCT CACTTGTG?3′(228 bp);Caspase?3引物序列为:上游 5′?GGAGCTGGACTGTGGCATTGA?3′,下游 5′?CA GTT CTTT C G TGAGCATGGA?3′(232 bp)内参照β?Actin序列为:上游5′?ATT GTAA C CA A CTGGGAC G?3′,下游5′?TTGCCGATAGTGATGACCT?3′(533 bp).
1.2.7Western Blot检测肺组织蛋白和线粒体内蛋白提取后,BCA法测定蛋白含量,按每泳道加总蛋白50 μg进行SDS?PAGE凝胶电泳,湿转致硝酸纤维素滤膜,50 g/L脱脂奶粉室温封闭2 h,加入小鼠抗大鼠Bax,Bcl?2,Caspase?3和Cyt c(1∶1000)一抗,4℃孵育过夜,TBST洗膜4次,每次15 min,加入辣根过氧化物酶标记的二抗(1∶6000),ECL增强化学发光系统显色20 min,X光片曝光. β?actin作为内参照对上样一致性进行评估. 采用GDS?8000型凝胶成像分析系统进行半定量分析.
统计学处理:应用SPSS13.0进行数据分析,组内比较采用单因素方差分析,大鼠死亡率应用χ2检验,数据以x±s表示. P<0.05为差异具有统计学意义.
2结果
2.1RES对大鼠腹水量、死亡率的影响SO组,SAP组,RES组和DEX组大鼠死亡率分别为:0.0%(0/8);50.0%(8/16);27.3%(3/11);38.5%(5/13). RES和DEX组大鼠死亡率较SAP组明显降低(P<0.05).
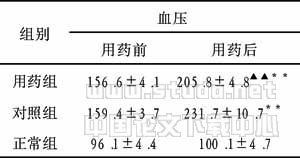
2.2RES对大鼠PaO2水平和腹水量的影响SAP组PaO2水平较SO组显著下降,与SAP组比较,RES组PaO2水平明显提高. SO组大鼠腹腔内无腹水,SAP组腹腔内存在大量暗红色血性腹水,RES和DEX组腹水计量结果低于SAP组(P<0.05,表1).
2.3RES对大鼠血浆TNF?α和IL?6水平的影响SAP组TNF?α和IL?6含量较SO组明显升高,在应用RES后,血浆TNF?α和IL?6水平明显下降(P<0.05,表1).表1RES对大鼠PaO2,TNF?α,IL?6和腹水计量的影响
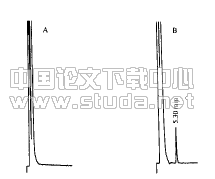
2.4肺脏和胰腺组织病改变光镜下观察可见,SO组胰腺组织无明显病理学改变;SAP组胰腺组织实质坏死、出血及炎性细胞浸润均较严重,提示SAP模型建立成功;而RES和DEX组胰腺组织病理改变均较SAP组明显减轻. 组织透射电镜观察可见SAP组肺组织存在典型细胞凋亡、线粒体肿胀、细胞水肿、毛细血管充血、血栓形成等病理改变,而RES组和DEX组肺组织上述变化明显减轻(图1).
2.5RES对肺组织Bax,Bcl?2,Caspase?3 mRNA表达的影响SO组,SAP组,RES组和DEX组肺组织Bax表达水平分别为:(6.09±0.18)%,(13.6±0.87)%,(9.14±0.34)%,(11.78±1.08)%;Bcl?2 mRNA表达分别为:(4.69±0.33)%,(2.58±0.81)%,(5.90±0.50)%,(5.31±0.18)%;Caspase?3 mRNA表达分别为:(4.77±0.47)%,(12.83±0.30)%,(10.11±0.52)%,(11.10±0.85)%. SO组Bax和Caspase?3 mRNA的表达相对较低或不表达;SAP组Bcl?2 mRNA表达水平稍有上升,Bax mRNA表达水平明显上升,RES组和DEX组Bcl?2 mRNA表达水平较SAP组明显上升(P<0.05),Bax和Caspase?3 mRNA表达水平明显下降(P<0.05,图2).
2.6RES对肺组织Bax,Bcl?2,Caspase?3,Cyt c蛋白表达的影响SO组,SAP组,RES组和DEX组Bax蛋白表达水平分别为:3825?59±194?56,16651?22±922.73,9912.98±503.16,16192.36±832.24;Bcl?2表达分别为: 5335.52±368.26,2979.15±125.13,7712.35±815.92,65.06.99±344.36;Caspase?3表达分别为:7743.31±316.83,14516.54±861.18,10023.67±213.68,10067.53±955.57;Cyt c表达分别为:9737.48±357.78,3473.79±313.16,7221.56±438.72,5630.61±452.87. SO组Bax,Bcl?2,Caspase?3均为较低水平表达,线粒体内Cyt c蛋白呈高水平表达. SAP组Bax和Caspase?3表达明显高于SO组,Bcl?2和Cyt c蛋白表达明显低于SO组(P<0.05). 与SAP组相比,RES和DEX组各时间点Bax和Caspase?3蛋白表达明显降低,Bcl?2和Cyt c蛋白表达明显升高(P<0.05,图3).
3讨论
在SAP并发的多器官功能损伤中,肺损伤的发病率约为20%[5]. 多数学者认为炎症介质如TNF?α,IL?6介导了肺损伤过程,是造成肺损伤的主要原因[6]. 但是其损伤机制至今仍不清楚. 近年来,细胞凋亡的增加在炎症性疾病所致的器官损害中的作用受到越来越多的重视. 在调控细胞凋亡的诸多通路中,线粒体通路因其在细胞凋亡调控中所起到的关键作用而受到广泛研究. 我们在成功建立大鼠SAP模型以后,随着血浆TNF?α,IL?6水平升高,线粒体通路中凋亡调控基因和相关蛋白表达出现上调,而同时肺组织病理损害程度也相应加重,提示由线粒体通路介导的细胞凋亡参与了SAP时肺功能损害的病理生理过程.
在线粒体通路中,Bcl?2家族是一族重要的凋亡调控基因[7]. 促凋亡的Bax激活后与Bcl?2结合,造成线粒体膜电位下降,进而导致线粒体内Cyt c从线粒体内释放到细胞浆,Cyt c从线粒体释放到胞质后,和细胞质中的Apaf?1结合形成复合物,再将Caspase?9募集到这个复合物中并将其裂解,从而激活Caspase?3,最终导致细胞凋亡的发生. 本研究在应用RES后,促进细胞凋亡的Bax和Caspase?3表达明显减弱而抑制细胞凋亡的Bcl?2表达明显增强,线粒体内Cyt c含量也明显增加. 与此同时,反映肺脏功能的PaO2水平较SAP组也明显上升,肺组织病理变化减轻,大鼠腹水量和死亡率也显著降低. 说明RES可以通过抑制线粒体通路中Bax和Caspase?3的表达和上调Bcl?2的表达,进而降低肺组织凋亡来实现对肺脏功能的保护作用.
综上所述,RES在大鼠SAP过程中具有较明显改善肺脏损伤程度的作用. 下调线粒体通路中Bax,Caspase?3和上调Bcl?2基因与蛋白的表达,从而抑制肺组织凋亡是其可能的作用机制之一.
【】
[1] 刘学民,徐军,王自法,等. 大剂量地塞米松对SAP肺损伤的治疗作用[J]. 第四军医大学学报,2005,26(17):1573-1575.
[2] 李丙所,蔡文科,任彦顺. wortmanni对重症急性胰腺炎大鼠胰肺损伤的保护作用[J]. 中华普通外杂志, 2007,10(16):976-978.
[3] Wang LC, Ma QY. Effects of resveratrol on calcium regulation in rats with severe acute pancreatitis[J]. Eur J Pharm, 2008,500(2):271-276.
[4] 秦勇,马清涌,党晓燕. 白藜芦醇对早期重症急性胰腺炎大鼠多器官组织氧自由基的影响[J]. 西安大学学报(医学版), 2007,28(5):572-574.
[5] 潘登,贾宝全,曹农. 还原性谷胱甘肽对急性坏死性胰腺炎肺损伤的影响[J]. 第四军医大学学报, 2007,28(5):407-410.
[6] 彭慈军,赵鹏,兑丹华. 清胰Ⅱ号对大鼠重症急性胰腺炎肺损伤的保护作用[J]. 第四军医大学学报, 2007,28(19):1757-1759.
[7] 徐军,刘学民,马清涌. 中性粒细胞在大鼠急性重症胰腺炎肺损伤中的作用机制[J]. 第四军医大学学报, 2005,26(16):1472-1474.