逆灌脑保护的作用机制研究
【摘要】 目的 旨在探讨维持脑低温是否作为逆灌脑保护的主要作用机制。方法 15℃深低温停循环120min期间,15头猪被分为3组:A组(n=5),停循环;B组(n=5),23~29mmHg压力冷血逆行脑灌注;C组(n=5),34~40mmHg压力冷血逆行脑灌注。然后,在37℃下转流60min。深低温停循环以脑皮层15℃为标准。连续监测脑、食管和灌注血液的温度。激光多普勒血流仪测定脑血流量,脑动、静脉血氧含量氧摄取率。结果 在降温和复温期间,脑温度的变化比食管温度要慢。不论停循环还是逆灌保护,脑组织都复温2℃~3℃,表明逆灌不能有效地维持停循环期间的脑低温,逆灌能维持躯体低温。逆灌期间,氧摄取率上升,提示逆灌可以提供营养血流到脑组织。结论 在猪的急性模型,逆灌产生的脑保护作用机制主要不是维持脑的低温,而是提供营养血流或氧到脑组织。
【关键词】 逆行脑灌注;深低温停循环;脑温度;脑保护
【Abstract】 Objective This study was to determine if retrograde cerebral perfusion (RCP) improves brain protection mainly as a result of its ability to maintain cerebral hypothermia in a pig model.Methods Fifteen pigs were subjected to 120 minutes of hypothermic circulatory arrest (HCA) alone (A group,n=5),HCA+RCP at perfusion pressures of 23~29mmHg(B group,n=5),or at perfusion pressures of 34~40 mm Hg(C group,n=5) at 15℃,followed by 60 minutes of normothermic cardiopulmonary bypass.After brain temperature reached 15℃,HCA was initiated with or without RCP.Temperatures in the brain,esophagus,and perfusate/blood were monitored continuously.Brain tissue blood flow was measured continuously using a laser flowmeter.Brain oxygen extraction was calculated from the oxygen contents in arterial and venous blood samples.Results The change in temperature was slower in the brain than in the esophagus during cooling and rewarming.A similar degree of spontaneous rewarming (from 15℃ to 17~18℃)occurred in the brain during both HCA and RCP,indicating RCP does not provide better maintenance of cerebral hypothermia during circulatory arrest relative to HCA alone.The esophageal temperature rose more slowly during RCP than during HCA alone,indicating that RCP maintains better hypothermia in the body.During RCP,oxygen was extracted continuously from the blood by the brain,indicating that RCP may provide nutrient flow to the brain.Conclusion In an acute pig model,cerebral hypothermia does not appear to be a principal mechanism by which RCP improves brain protection.Retrograde cerebral perfusion seems to provide nutrient flow/oxygen to brain tissue,leading to better brain protection.
【Key words】 retrograde cerebral perfusion;hypothermic circulatory arrest;brain temperature;brain protection
逆行脑灌注结合深低温停循环的脑保护方法已经应用在主动脉弓置换和复杂性心脏病的手术,其作用机制尚未阐明。从理论上分析,逆灌可以提供一定量的营养物质,维持深低温停循环期间脑的代谢活动和脑的低温;逆灌血流可以冲刷脑内代谢废物和微栓[1]。然而,我们的研究和其他学者的结果显示,逆行脑灌注只能提供非常有限量的脑血流,大约是顺灌值的4%~6%[2,3]。逆灌能否维持脑组织的低温我们做了进一步的观察,现报告如下。
1 材料与方法
1.1 实验动物 15头健康、成年约克郡猪,体重56~73kg。提前12天被饲养,手术前12h禁食,不禁水。动物模型与以前报道相似[4]。
1.2 麻醉方法 麻醉诱导使用咪唑安定0.3mg/kg,盐酸氯胺酮20mg/kg和阿托品0.02mg/kg肌注。肌肉松弛剂应用潘可罗宁0.1mg/kg。经气管内插管,人工呼吸机辅助,吸入气体含60%氧,呼吸频率和潮气量调节至维持动脉二氧化碳压力35~45mmHg。
1.3 实验方法 (1)显露双侧颞部颅骨,右侧钻开直径0.5cm小孔,暴露硬脑膜。用来放置激光多普勒血流仪。左侧钻开直径0.3cm小孔,微型温度探针(omega,0.5mm直径)经硬脑膜刺入皮层内1.5cm。头颅周围无冰袋保护,室温保持在22℃。(2)胸骨正中劈开,全身肝素化。经右侧胸廓内动脉置入一根细小管子至双侧颈动脉开口处,连续监测动脉压,抽取逆灌期间的静脉血样。通过左侧胸廓内静脉置入一根细小管子至右侧颈内静脉(超过静脉瓣),获取体外循环期间的静脉血样和监测逆灌压力。升主动脉插管(F22#),经右心耳置入腔房管(F28#)一根,建立体外循环。体外循环期间,脱开呼吸机连接。(3)体外循环采用cobe滚压泵(model c22.2)、膜式氧合器(cobe optima),动脉端安装40μm直径微过滤器(40micron,dideco D733)。预充液包括乳酸林格氏液1000ml,长效羟乙基淀粉500ml,1mol碳酸氢钠25ml,肝素5000IU。泵流量65~80ml/(kg·min)保持平均血压60mmHg以上。红细胞压积20%左右,术中不使用血管活性药物。连续测定动脉血压、中心静脉压、泵流量和温度。(4)实验分组:15头猪被体外循环降温至脑皮层温度15℃,并随机分为3组:A组(n=5),深低温停循环120min。B组(n=5),120min深低温停循环期间,使用23~29mmHg压力的冷血逆行脑灌注。C组(n=5),120min深低温停循环期间,使用34~40mmHg压力的冷血逆行脑灌注。(5)分别建立脑、食管和血液温度测定装置。37℃下转流20min,以达到体温和血气值的平稳。获取基础对照值后,全身降温至脑皮层温度15℃。降温幅度保持血液和食管之间的温差<10℃,降温时间45~55min。然后,深低温停循环120min,单纯或辅助不同压力的脑逆灌。逆灌血的温度被控制在13℃~14℃,静脉血回流通过下腔静脉和升主动脉插管引流到储血器内。术中奇静脉保持开放状态。结束深低温停循环逆行脑灌注后,逐渐复温至37℃并继续体外循环60min。整个实验过程没有使用血管活性物质。
1.4 实验指标
1.4.1 脑皮层血流量 使用ALF21R激光多普勒血流仪(Advance company Ltd Tokoyo,Japan)和直径1.5mm的针样探头(Type Nspi,9051U)测定脑皮层血流量。
1.4.2 温度测定 各种温度探头被分别置在大脑皮层、食管腔内和动脉灌注管的内表面,同时记录温度变化。
1.4.3 脑组织氧消耗 同时抽取动、静脉血样。自动血气分析仪(stat 9,NOVA Biomedical)立即测定血气值。血液pH测定采用alpha稳态法。氧容量=血红蛋白×1.36×氧饱和度+氧分压×0.003,氧摄取率=(动脉氧容量-静脉氧容量)÷动脉氧容量×100%。
1.5 统计学方法 全部资料显示平均数加减标准差(x±s)。在常温37℃下测定的平均脑血流量设定为100%的对照值。统计分析使用分析软件(SAS Institute,Cary,NC)。ANOVA和Duncan 多因素方差分析比较组内差异。Student’t检验检测2组之间的差异。P<0.05 被考虑为差异有显著性。
2 结果
2.1 一般情况比较 猪的平均重量,A组(60.0±0.9)kg,B组(58.7±1.1)kg,C组(58.7±1.9)kg(P>0.05)。降温时间分别为(48±2)min、(49±1)min、(49±2)min,3组之间差异无显著性。复温过程3组之间差异无显著性[(45±2)min、(46±3)min、(47±3)min],见表1,3组在实验过程中的血流动力学指标稳定。体外循环期间各组的血压和泵流量差异无显著性,血红蛋白含量在降温过程中由于添加晶体液有轻度降低。血液pH值维持在正常范围内。逆灌期间,泵流量C组高于B组,差异有显著性(P<0.05)。
表1 各组血气、红细胞压积、血压和灌注流量比较 (x±s)
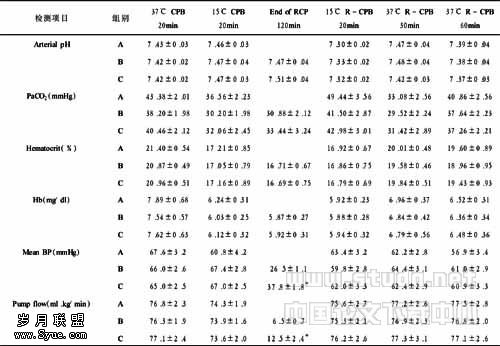
注:与23~29mmHg组比较,*P<0.052.2
脑皮层血流量 脑皮层血流量受温度影响,15℃时脑皮层血流量降低至基础值的49%~52%。复温至37℃后大脑皮层血流量恢复到基础值。为了排除温度的影响,15℃时测定的脑血流量作为100%的基础值(见图1)。图1显示C组在逆灌期间的脑血流量(11.78%~13.74%),明显高于B组(3.76%~5.16%),差异有非常显著性(P<0.01)。
2.3 温度变化 从25℃到15℃的降温过程中,3组食管温度降低的速度明显比脑温要快,两者相差2℃~3℃。当脑温达到15℃时,食管温度为13.1℃~13.8℃,通常较食管温度迟10~15min。复温时食管温度上升要快于脑温,两者温差约9℃。停循环期间,A组食管温度缓慢回升,从13.1℃到16.8 ℃; 早期45min,脑温从15℃上升到17.4℃,其余75min脑温仅仅上升0.14℃。A组在起始60min,脑温明显高于食管温度,但是这种差别在后来的60min消失(见图2)。逆行脑灌注时,B、C 2组间的血温变化差异无显著性。B组食管温度从13.4 ℃上升到14.6 ℃; 45min内,脑温从15℃上升到16.7 ℃,剩余75min脑温上升0.16℃。C组食管温度从13.4 ℃上升到14.9 ℃,在早期45min内,脑温从15 ℃上升到16.5℃,剩余75min脑温上升0.22℃。逆灌期间两组的脑温均高于食管温度(见图3、图4)。停循环期间,深低温停循环组的食管温度回升,较逆灌两组要快,75min后差异存在显著性(P<0.05)。低压和较高压力的逆行脑灌注之间差异无显著性(见图5)。脑温的变化3组非常相似,深低温停循环组比逆灌组高1℃,但差异无显著性(见图6)。
2.4 脑组织氧摄取率 37℃时脑组织氧摄取率在A、B、C 3组分别是(23.9±5.3)%,(24.2±1.1)%,(24.5±2.7)%,15℃时,为(7.6±1.1)%,(7.5±1.4)%,(7.6±2.3)%。说明深低温15℃脑仍然消耗氧。15min逆灌时,B组氧摄取率达(65.4±4.9)%,C组为(45.0±5.2)%,以后C组逐渐增加,在120min到达最高值为(64.1±3)%,表示34~39mmHg压力组能为脑组织提供较多的氧(见图7)。在逆灌期间,2组的脑组织氧摄取率明显增加,提示脑组织利用有限量的逆灌血流和逆灌可以提供营养血流。
3 讨论
逆灌脑保护研究,早期采用犬的模型。犬具有细小的颈内静脉和较多的静脉瓣,只能采用双侧颧静脉替代颈内静脉灌注;结果显示逆灌时脑血流值偏高,约为同一温度顺灌值的30%~50%[5]。猪的血管解剖比较接近人类,是研究逆灌脑保护应用最多的动物。在猪和猿的动物模型,逆灌只能提供小于顺灌值10%的血流。Lin PJ等人利用多普勒血流仪直接测定人硬脑膜下脑血流,发现逆灌脑血流量约10%。由于有限的脑血流量,考虑逆灌对脑的保护作用是较好地控制了温度,而不是提供了营养血流[6]。本研究比较清楚地表明,在降温和复温过程中,脑温和躯体中心温度之间有较大的差异,脑温度的变化比食管温度要慢,特别是在复温期间。脑组织的复温不单纯发生在深低温停循环组,同样出现在逆行脑灌注组。躯体温度的上升在逆灌组明显比深低温停循环组要慢,提示逆灌能较好地维持躯体温度,但不能有效控制停跳期间脑的温度上升。这可以用逆灌时的分流来解释,已经证实静脉系统存在大量的侧支循环,逆灌血流经侧支循环而大量分流到躯体循环。同样提示逆灌不但保护脑组织也可能保护其他器官[2]。
利用染料灌注法观察脑逆灌分布的结果,绝大部分逆灌血流分布在脑皮层的表面[2]。在未麻醉的患者,80%的脑血流分布在灰质,20%在白质[7]。我们将温度探头置在皮层的灰质区,因为,该区域的温度较容易受到逆灌血流的影响,而深层的白质受的影响较小。脑温度的变化明显较食管温度要慢,温差在降温期间是2℃~3℃,复温期间最高可达到9℃。脑温达到15℃较食管温度晚10~15min。在临床实践中,降温至15℃后应当继续转流降温10~15min,然后停循环。我们设定深低温停循环以脑温15 ℃为标准,这样他们的基础值一致,在120min停循环期间,不论单纯停跳还是辅助逆灌都显示出脑温自然上升,上升范围约2℃左右,停跳45min达到最高。为什么停跳后脑组织会自动升温尚不清楚,可能由于脑实质内热量的释放或头颅周围组织和室温的影响。在研究过程中,我们将室温严格控制在22℃,猪的头颅没有用冰敷。因为局部头颅冰敷可以预防脑组织的自然升温和进一步的脑降温。
Juvonen发现,90min深低温停循环期间的硬脑膜表面温度,顺灌比逆灌要高,单纯停跳高于逆灌。从而认为脑逆灌的保护作用主要是维持了停跳期间颅内低温[8]。但是他们观察的是硬脑膜表面的温度而不是脑组织的温度。我们在实验中观察到,硬脑膜表面的温度与脑组织温度存在差异。硬脑膜表面的温度易于受到环境温度的影响。然而,他们的报道尚未阐明,头颅局部冰敷是应用在全部组还是用在单纯低温或逆灌组。若所有各组的血温和局部冰敷都一致,为什么硬脑膜温度在顺灌组反而高于停跳组和逆灌组,似乎难以解释。从理论上讲,顺灌提供较逆灌更多的脑血流,能够更好地控制脑温。我们直接测定脑皮层温度,各组的基础温度一致,灌注血温得到良好的控制,有利于各组之间比较。结果清楚表明,逆灌并不能防止脑组织温度的上升或者维持脑的低温。脑温度的变化在深低温停跳组和脑逆灌组是相似的。虽然较高的逆灌压力可以增加脑血流,但不能维持脑组织恒定的低温。
Mezrow等学者指出[9],在猪的动物模型,18℃脑代谢降低至32%~40%,全身代谢降到16%。我们的研究结果,15℃脑组织氧摄取率为33%。表明深低温15℃仍然存在脑的代谢,脑组织仍然需要氧消耗。核磁共振光谱测定显示,15℃时停循环和逆灌30~50min后脑组织ATP含量已经测不到[10]。因此,在延长停循环期间能连续供应氧或血液极为重要。逆灌提供一定量的营养血流,增加逆灌压力从23~29mmHg到34~40mmHg并不能有效地维持脑的低温,但可以增加皮层血流,较好地保存神经元的代谢功能和组织酶活性。这提示34~40mmHg压力改善脑的保护作用主要是供给血流或营养。逆灌提供的脑血流量非常有限,是正常血流的2%~8%,远远低于15℃时的脑代谢率(33%的水平)。逆灌超过60min仍然可以发生脑损伤。
在猪的动物模型,120min停循环期间,逆灌能较好地维持躯体的低温;但逆灌不能预防脑组织自然升温。逆灌保护脑的主要作用机制不是较好地维持脑组织的低温,可能是提供了一定量的营养血流或氧到脑组织,从而预防缺血性损伤。
(本文图片见附页1)

【】
1 Bavaria JE,Pochettino A.Retrograded cerebral perfusion in aortic arch surgery:efficacy and possible mechanisms of brain protection.Semin Thorac and Cardiovasc Surg,1997,9:222-232.
2 Ye J,Yang LJ,Del Bigio MR,et al.Retrograde cerebral perfusion provides limited distribution of blood to the brain:a study in pigs.J Thorac Cardiovasc Surg,1997,114:660-665.
3 Li ZJ,Yang L,Jackson M,et al.Increased pressure during retrograde cerebral perfusion in an acute pig model improves brain tissue perfusion without increase in tissue edema.Ann Thorac Surg,2002,73:1514-1521.
4 Ye J,Ryner LN,Kozlowski P,et al.Retrograde cerebral perfusion results in flow distribution abnormalities and neuronal damage,a magnetic resonance imaging and histopathological study in pigs.Circulation,1998,98:313-318.
5 Usui A,Oohara K,Liu TL,et al.Determination of optimum retrograde cerebral perfusion conditions.J Thorac Cardiovasc Surg,1994,107:300-308.
6 Lin PJ,Chang CH,Tan PP,et al.Prolonged circulatory arrest in moderate hypothermia with retrograde cerebral perfusion.Is brain ischemic? Circulation,1996,94(9 Suppl):169-172.
7 Miller RD.Anesthesia,3rd ed.New York:Churchill Livingstone,1990,627-629.
8 Juvonen T,Zhang N,Wolfe D,et al.Retrograde cerebral perfusion enhance cerebral protection during prolonged hypothermic circulatory arrest:a study in a chronic pocine model.Ann Thorac Surg,1998,66:38-50.
9 Mezrow CK,Gandsas A,Sadeghi AM,et al.Metabolic correlates of neurologic and behavioral injury after prolonged hypothermic circulatory arrest.J Thorac Cardiovasc Surg,1995,109:959-975.
10 Filgueiras CL,Ryner L,Ye J,et al.Cerebral protection during moderate hypothermic circulatory arrest:histopathology and magnetic resonance spectroscopy of brain energetics and intracellular pH in pigs.J Thorac Cardiovasc Surg,1996,112:1073-1080.











