超声消融粥样硬化斑块的体外研究
1 材料与方法
1.1 仪器、血管收集与超声干预 超声处理机由超声发生装置、换能器、超声导管构成。导管远端传统球型头端外,另两种为球型顶端为平截面型的头端以及球型前方带缺口的头端(以下分别简称导管Ⅰ、Ⅱ、Ⅲ型)。Siegel等方法[3],闭塞冠脉片段长度2~5cm,取自12h内的死亡病人,肉眼和触觉判断血管片段为粥样硬化斑块病变,血管造影确认100%闭塞。超声干预时,导管头端与闭塞病变部位结合,超声消融从闭塞近端至远端,当有明显突破感及阻力消失时即停止超声释放。根据应用的三个超声导管类型,血管条相应分成三组(n=10)。
1.2 超声消融速率和组织化学研究 参考Siegel等方法[3],根据消融时间与血管病变长度,出超声消融速率(mm/s)。血管再通后片段送组化研究,观察管腔内动脉粥样硬化物质和血管壁的形态学变化,利用医用形态软件(Leica Owin)进行定量分析,比较几种导管干预后的血管壁和闭塞病变组织损伤程度。
1.3 不同导管超声空化效应及强度的研究 为明确导管形态对超声消融能力的影响机制,导管插入带蒸馏水的试管内并释放超声,观察记录超声空化流现象并利用强度测量仪计算出相距超声导管头端不同距离处的超声波强度,以测量仪相隔超声导管头端的距离为横坐标(mm),该位置处测量的超声强度为纵坐标(w/cm2),根据数据作图分析。
1.4 消融后碎片研究 参考Rosenchein等方法[4],干预后冠脉片段内腔用蒸馏水冲洗,冲洗液经专用滤纸过滤。得到样本随后用电镜方法检查,采用形态分析软件对碎片进行测量。
1.5 统计学处理 数据表达为均数±标准差(x±s),若为非正态分布,数据表达方式为:M(P25-P75),即:中位数(下四分位数—上四分位数)。在软件Statistic 6.0上运算,P<0.05为差异有显著性。
2 结果
2.1 超声消融速率与组化研究 不同超声导管均成功消融闭塞冠脉内粥样硬化斑块病变组织,与Ⅰ型和Ⅱ型导管比较,Ⅲ型的消融速率更慢,差异有非常显著性(P<0.01),见表1。
切片研究提示,在超声干预下,闭塞的粥样硬化组织出现大、小块的分解、斑块断裂等形态变化;血管壁则出现中膜分层、局部断裂、甚至管壁穿孔改变。Ⅱ型导管组中,血管壁穿孔发生率较高(60%);而其他两组为10%,与Ⅱ型导管组比较差异有显著性(P<0.05)。面积定量分析表明,超声波可以明显消融闭塞病变组织,但同时也对血管壁有一定的破坏作用。不同类型的导管在破坏管壁和闭塞物质的程度上差异无显著性,见表1。
表1 不同超声导管消融闭塞组织、再通闭塞动脉后观察指标超声导管
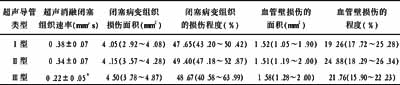
注:与Ⅰ型、Ⅱ型导管比较差异有非常显著性,*P<0.01

2.2 超声空化效应及强度的研究 实验发现,导管Ⅰ型的超声空化流从导管头端表面直到前方18mm左右均可见,Ⅱ型则从头端到前方约10mm可见空化流,Ⅲ型导管产生的空化流仅到达头端前方仅5mm左右。测量后表明,随着相距导管头端距离的延长,超声波强度逐步衰减。比较不同的导管类型可以发现,在相距导管头端2~5mm处,导管Ⅲ型的超声波强度衰减迅速,导管Ⅰ、Ⅱ型的衰减速度则总体上慢于导管Ⅲ型;在离开导管头端相同距离处的超声波强度,Ⅰ型导管始终最大 (图1)。

2.3 消融碎片研究 电镜形态学分析软件(Genias 26)结果示,三种超声导管消融后的动脉粥样硬化组织碎片多数为类圆粒型 (图2);Ⅰ、Ⅱ型导管组的碎片直径100%在10微米(μm)以下;Ⅲ型导管组碎片直径中90.4%在10μm以下,与Ⅰ和Ⅱ型导管组比较差异有显著性(P<0.05)。三组间的比较结果示,Ⅰ型导管组碎片最小,Ⅲ型导管组最大(P<0.0001)。图1 相距导管头端不同距离处的超声波强度变化图2 超声消融后碎片形态
超声血管成形术被认为是一种新颖和有前景的技术。其消融粥样硬化斑块的主要机制是利用低频高能超声的机械效应和空化作用[5]。导管类型不同,会在机制上影响消融的效果,本实验即比较三种导管设计对超声消融能力的影响,研究将有利于指导超声导管的改进。
实验发现,超声消融斑块、再通闭塞血管的速度在应用Ⅰ和Ⅱ型导管时(头端为球型或者带截面的球型)要高于应用Ⅲ型导管(球型头端,顶端带缺口)。这是因为不同导管作用时的空化与机械效应不同。实验表明,Ⅲ型导管头端由于其表面有缺口,产生的空化场方向上发散,其空化流的距离短,在强度上衰减也快(参见结果图1),而Ⅰ型和Ⅱ型导管设计避免了空化场的发散,与闭塞组织接触处单位面积内的超声波作用强度则较高;单从再通血管的速率上看,Ⅰ和Ⅱ型导管均好于Ⅲ型。虽然Ⅱ型导管的空化流发射距离和相同距离下的强度不如Ⅰ型导管,但其球型头端有平截面,边缘成角,可能加强了消融原理中的机械效应,因此与Ⅰ型导管相似,消融再通血管速率快于Ⅲ型导管。总之,导管头端变化带来了不同的机械与空化效应,导致不同的消融能力。此外,从血管组化结果的分析来看,在血管壁和闭塞组织的破坏面积与程度上,三种导管差异并无显著性。然而,Ⅱ型导管应用时伴随更高频率的血管壁穿孔发生。我们认为,这可能是因为该导管头端有平截面,两边缘成角,是造成管壁穿孔主要因素。因而,从安全角度看,Ⅱ型导管不如Ⅰ和Ⅲ型。消融后的碎片大小是分析安全性的另一重要因素,该实验结果证实,在Ⅰ、Ⅱ型导管组全部碎片直径小于毛细血管(10μm),优于Ⅲ型导管组;所有三组导管中,球型头端的导管(Ⅰ型)干预后的碎片直径最小。这与不同导管超声强度实验的结果相符合。超声强度越大,病变组织被消融的程度越大,碎片也就最小。
综上所述,在超声介入消融动脉粥样硬化病变中,传统球型头端导管(Ⅰ型)仍应是目前选择。在超声介入技术的研究探索过程中,应考虑到导管形态是超声消融能力和安全性方面的重要影响因素。随着更多基础和临床研究的进展,超声血管成形术会逐步成熟,真正成为动脉粥样硬化治疗辅助手段之一。
【】
1 Brosh D, Bartorelli AL, Cribier A. Catheter Cardiovasc Inverv,2002,55:43-49.
2 Gun J, Cumberland DC, Siegel RJ. Echocardiography,2001,18:213-217.
3 Siegel RJ, DonMichael TA, Fishbein MC, et al.JACC,1990,15: 345-351.
4 Rosenschein U, Rozenszajn L, Ludvig K, et al. Circulation,1991,83:1976-1986.
5 Rosenschein URI, Frimeman A, Laniado S, et al. Am J Cardiol,1994,74:1263-1266.











