大鼠类风湿性关节炎破骨细胞分化因子及骨保护素的基因表达研究
作者:韩冰,张家颖,武广恒,徐勇忠
【摘要】 目的 本研究以大鼠的类风湿性踝关节炎为实验模型,采用RT-PCR技术检测大鼠踝关节组织中破骨细胞分化因子(ODF/RANKL)、骨保护素(OPG)的表达,探讨关节组织中RANKL、OPG表达与类风湿关节炎骨吸收破坏的分子生物学机制。方法 建立大鼠实验动物模型。采用逆转录-聚合酶链式反应(RT-PCR)的方法,检测实验组不同时间大鼠踝关节组织中RANKL、OPG mRNA基因表达。结果 通过RT-PCR 方法检测大鼠踝关节组织中RANKL及OPG mRNA含量,并对其含量进行比较,在正常对照组OPG mRNA的含量高于RANKL mRNA,而随着模型构建成功,RANKL/OPG mRNA的含量比值出现倒置,RANKL mRNA的含量渐升高,其比值4周时为9∶1,6周时为6.4∶1。结论 随着关节破坏程度的加重,RANKL mRNA组织中的表达量增加,OPG的表达量也增加,RANKL/OPG的比值增加程度比OPG增加明显,在模型建立4周时达到9∶1,表明RANKL与OPG的表达比例与破骨细胞的功能、活性、分化与成熟呈正相关。局部微环境中RANKL与OPG的相对比值决定骨组织中破骨细胞与成骨细胞功能倾向,决定局部骨组织是吸收、破坏还是增生,而且决定骨的破坏程度。
【关键词】 类风湿性踝关节炎 破骨细胞分化因子 骨保护素 基因表达
Gene expression of osteoclastogenesis inhibitory factor and osteoclast differentiation factor in rat ankle rheumatoid arthritis
【Abstract】 Objective To take the rat ankle rheumatoid arthritis as animal model,and to assay the expression of osteoclast differentiation factor in ankle rheumatoid arthritis(ODF/RANKL)and osteoprotegerin(OPG)in the rat ankle tissue by the means of molecular biology.To discuss the relationship between extent of bone tissue destruction and expression of RANKL and OPG,and to discuss the molecular biology mechanism of bone tissue destruction in rheumatoid arthritis.Methods The rat animal model was established.The variety of RANKL and OPG expression by means of RT-PCR was assayed.Results With the inflammation worsening and the bone destruction, the RANKL mRNA expressional quality was arisen.By comparing the expression of RANKL mRNA with that of OPG mRNA, we could draw a conclusion that the values in normal control group were changed into invert ratio when the joint inflammation was worse. And the ratio was 9∶1 when it come to its climax. Conclusion With the increase of deterioration of the bone destruction,the ratio of RANKL/OPG is increased little by little,and the ratio comes to 9∶1 when inducing the animal model at the forth week. Regulated the extent of bone destruction by means of negative-feed, bone absorption or hyperplasia and the extent of the bone destruction depend on the ratio of RANKL and OPG in the local microenvironment.
【Key words】 ankle rheumatoid arthritis osteoclast differentiation factor osteoprotegerin gene expression
风湿性关节炎(rheumatoid arthritis,RA) 表现为慢性、对称性多滑膜关节炎和关节外病变的一种自身免疫、炎性疾病[1]。病情进展中综合体现了炎症、自身免疫、滑膜组织增生3种病理生理过程。许多证据表明,骨吸收是破骨细胞在成骨细胞(osteoblast,OB)参与下侵蚀骨质的生物学功能,体现OB 的接触依赖过程。成骨细胞和破骨细胞的细胞间接触是决定破骨细胞形成及功能活动的必要条件。因而,人们推测在成骨细胞的细胞膜上存在着一种膜结合因子,可以介导成骨细胞对破骨细胞分化及功能的调控,这一假设及其确切的分子机制直到近期才得以证实。1997年Simonet等[2]在胎鼠小肠组织构建的cDNA文库中发现了一种新的TNF受体家族成员,它具有降低破骨细胞分化和增加骨密度的功能,故命名为护骨因子(osteoprotegerin, OPG), 破骨细胞发生抑制因子(osteoclastogensis inhibitory factor,OCIF)。1998年有2个研究组分别发现了一种新的破骨细胞分化所必需的因子,分别将其命名为破骨细胞分化因子(osteoclast differentiation factor, ODF)[3]、OPG配体(osteoprotegerin ligand, OPGL)[4],RANKL/ODF被认为可能是唯一能够直接诱导破骨细胞分化和功能的细胞因子[5]。本实验是应用牛Ⅱ型胶原蛋白与弗氏佐剂为乳剂,制备Wistar大鼠类风湿性踝关节炎模型,应用RT-PCR 技术检测大鼠关节组织中ODF/RANKL mRNA及OPG mRNA表达,从分子生物学水平探讨类风湿性关节炎骨吸收破坏机制,为类风湿性关节炎骨吸收破坏机制的进一步探讨及早期诊断奠定了分子生物学基础。
1 材料与方法
1.1 一般材料
1.1.1 实验动物 Wistar大鼠48只,雌性,5周龄,体重约(120±15)g左右,由长春高新医学实验研究中心提供,随机分成正常对照组、实验组各24只。
1.1.2 主要试剂 (1)牛源性Ⅱ型胶原蛋白(collagen Ⅱ),酸可溶性,美国Sigma公司产品;弗氏完全佐剂(complete Freund’s adjuvant,CFA),美国Sigma公司产品。
1.1.3 逆转录酶、RNase 抑制剂和Trizol试剂 购自宝生物工程大连有限公司。
1.1.4 特异引物 由宝生物工程大连有限公司合成。(1)RANKL 扩增产物长度为822bp,引物顺序如下:上游引物:5’-GAGACTACGGCAAGTA-3’;下游引物:5’-CCTCCAACGTTTATGG -3’。(2)OPG 引物扩增产物长度为 603bp顺序如下:上游引物:5’-TGGAGCTCGAATTCTGCTTG-3’;下游引物:5’-CATCAAGATGCGGAGCTGCT-3’。(3)大鼠β-actin引物扩增产物长度为410bp,顺序如下: 上游引物:5’-GAAATCGTGCGTGACATTAAG-3’;下游引物:5’-CTAGAAGCATTTGCGGTGCA-3’。β-actin 作为检测RANKL、OPG内参对照。
1.2 实验方法
1.2.1 实验组织制备 不同时间点实验组大鼠(0、2、4、6周)两侧踝关节组织取出后,右侧用10%福尔马林固定后,用于活组织检查。左侧踝关节组织放入液氮罐内以备用来做分子生物学指标检测。
1.2.2 组织总RNA提取 紫外分光光度计测定RNA含量和纯度RT-PCR检测RANKL、OPG、CTR mRNA基因表达,利用基因公司凝胶成像分析系统2 结果见图1,2,3。图中0周组为实验对照组,2、4、6周组为异种胶原诱导注射后各不同时间实验组。
RANKL mRNA 在正常对照组微弱表达,随着关节炎症状和关节骨吸收程度的加重而升高,表达量在诱导注射第4周时达到高峰,6周时由于吸收破坏仍继续,RANKL mRNA 的含量继续处于高值。见图1。
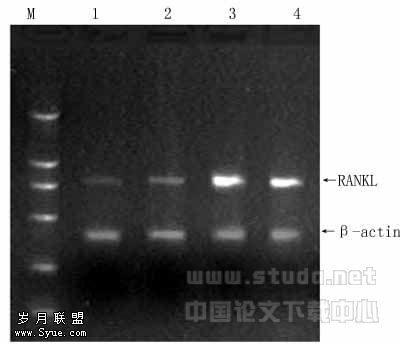
图1 RT-PCR检测大鼠RANKL mRNA表达
OPG mRNA在正常对照组呈弱表达,随关节破坏程度加重,其表达量渐升高。见图2。
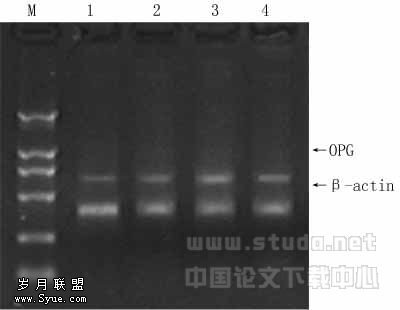
图2 RT-PCR检测大鼠OPG mPNA表达
图1,2各泳道如下:M:DL-2000;1:对照组;2、3、4:分别为诱导注射2周、4周和6周组。
RANKL与OPG mRNA的含量进行比较,可以看出,在正常对照组OPG mRNA的含量高于RANKL mRNA的含量,RANKL与OPG比值为1∶2,而当大鼠异种胶原诱导注射后,RANKL与OPG mRNA比值出现倒置,RANKL mRNA的含量渐升高,在4周时其比值达9∶1,6周时比值为6.4∶1。见图3。
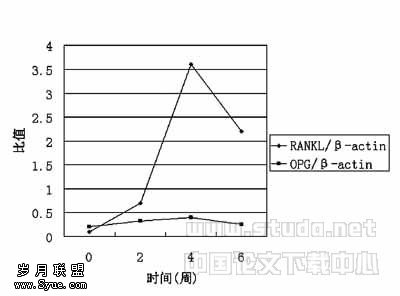
图3 大鼠RANKL/β-actin和OPG/β-actin比值
2 讨论
类风湿关节炎的骨质吸收和破坏有以下几种不同类型[6]:血管翳直接侵害关节边缘引起局灶性骨侵蚀;局灶性软骨下骨侵蚀;炎症关节的关节端骨量减少。破骨细胞来源于关节滑膜组织中骨髓干细胞/巨噬细胞,同时大量的研究证明关节滑膜组织中的成纤维细胞(synovial fibroblasts)具有分化为破骨细胞的潜能[7]。骨吸收是破骨细胞在成骨细胞(osteoblast,OB)参与下侵蚀骨质的生物学功能,体现OB 的接触依赖过程[8],成骨细胞可能首先产生一种或多种酶介体,再作用于破骨细胞的前体细胞使之向破骨细胞分化,破骨细胞分化因子(ODF)就是这样一种酶介体[9]。其功能受骨保护素(OPG)反馈调节[10]。
本实验采用RT-PCR技术对大鼠踝关节标本进行检测,发现实验对照组大鼠(生后4周大鼠),其保护素(OPG)弱表达,破骨细胞分化因子(RANKL)呈微弱表达,RANKL/OPG mRNA间比值小于1;从大鼠的骨组织发育进程看,此时大鼠的骨骼处于新生发育阶段,成骨细胞发挥主要作用,以骨形成为主。而笔者的研究结果,OPG的表达量要高于RANKL的表达。
当大鼠注射异种胶原产生急性免疫反应,出现关节炎性病变时,关节组织RANKL、OPG表达出现了改变。经过注射异种胶原诱导关节炎2周后,检测RANKL mRNA表达量升高明显,OPG mRNA略有升高,RANKL/OPG比值(大于1)升高。而在这一时期的关节活组织检查,可以见到关节周围组织内毛细血管、关节滑膜增生, 髁突表面覆盖炎性细胞,髁突表面软骨可见骨吸收陷窝[11]。这与Romas的实验研究相符,在Romas等的研究中,对大鼠进行异种胶原诱导注射(注射1次)诱发膝关节炎19d时,检测RANKL/OPG表达改变结果,与笔者经2次诱导注射后2周时间大致相符,其细胞因子含量的改变亦相符,支持Evan Romas等的实验结果[12]。
随着关节破坏模型的建立,关节破坏程度加重,RANKL mRNA组织中的表达量增加,骨及软骨吸收破坏高峰期时RANKL mRNA表达量达到最高值,证明RANKL刺激破骨细胞的分化和成熟,从而导致骨的吸收破坏加重。
破骨细胞功能和活性是受破骨细胞分化因子和骨保护素这对竞争抑制因子所调控,随着关节破坏进一步加重,OPG的表达量随着关节破坏程度的加重也在增加,表明OPG作为RANKL 竞争抑制受体的调节作用。而RANKL/OPG的比值增加程度比OPG增加明显,在最后一次诱导注射模型建立4周时达到9∶1,此时表达破骨细胞的降钙素受体亦升至最高,表明RANKL与OPG的表达比例比局部RANKL表达量更能有效解释局部破骨细胞的功能活性改变。RANKL与OPG的表达比例与破骨细胞的分化与成熟、功能、活性正相关,RANKL刺激破骨细胞的增殖和分化,从而导致骨的吸收破坏加重。当关节破坏进入慢性过程时,RANKL/OPG mRNA表达略有下降,但其比值仍然较高,而且降钙素受体表达量持续呈高水平表达,提示此时的骨组织仍处于吸收破坏阶段,进一步验证了RANKL是骨吸收促进因子,促进破骨细胞的分化、成熟。在实验中OPG mRNA 表达量随着骨吸收破坏加重、RANKL mRNA表达增加而增加,考虑这是由于OPG是RANKL基因的“圈套”受体,受RANKL的负反馈调节,表达量相对也增加,从而能竞争性与RANKL结合,负反馈调节骨的破坏程度。局部微环境中RANKL与OPG的相对比值决定骨组织中破骨细胞与成骨细胞功能倾向,决定局部骨组织是吸收、破坏还是增生,而且决定骨的破坏程度。
【】
1 Golden BD, Wong DC, Dicostanzo D,et al. Rheumatoid papules in a patient with acquired immune deficiency syndrome and symmetric polyarthritis.J Rheumatol,1996,23(4):760-762.
2 Simonet WS, Lacey DL, Dunstan CR, et al. Osteoprotegerin: a novel secreted protein involved in the regulation of bone density. Cell,1997,89(2):309-319.
3 Thomas GP, Baker SU, Eisman JA. Changing RANKL/OPG mRNA expression in differentiating murine primary osteoblasts. J Endocrinol,2001,170(2):451-460.
4 Miyamoto T,Arai F, Ohneda O.An adherent condition is required for formation of multinuclear osteoclasts in the presence of macrophage colony-stimulating factor and receptor activator of nuclear factor kappa B ligand. Blood,2000,96(13):4335-4343.
5 Liu D, Xu JK, Figliomeni L,et al. Expression of RANKL and OPG mRNA in periodontal disease: possible involvement in bone destruction. Int J Mol Med,2003,11(1):17-21.
6 Gravallese EM. Bone destruction in arthritis. Ann Rheum Dis,2002,61(Suppl 2):ii84-86.
7 Takayanagi H, Oda H, Yamamoto S. A new mechanism of bone destruction in rheumatoid arthritis: synovial fibroblasts induce osteoclastogenesis.Biochem Biophys Res Commun,1997,240(2):279-286.
8 Shimizu-Ishiura M, Kawana F, Sasaki T. Osteoprotegerin administration reduces femural bone loss in ovariectomized mice via impairment of osteoclast structure and function. J Electron Microsc (Tokyo),2002,51(5):315-325.
9 Simonet WS, Lacey DL, Dunstan CR, et al. Osteoprotegerin: a novel secreted protein involved in the regulation of bone density. Cell,1997,89(2):309-319.
10 Tsuda E, Goto M, Mochizuki S. Isolation of a novel cytokine from human fibroblasts that specifically inhibits osteoclastogenesis. Biochem Biophys Res Commun,1997,234(1):137-142.
11 王海鹰,王从妙,王德文.大鼠多发性关节炎早期颞下颌关节的组织病研究.中华口腔医学杂志,2000,35(2):123-125.
12 Romas E, Bakharevski O, Hards DK. Expression of osteoclast differentiation factor at sites of bone erosion in collagen -induced arthritis. Arthritis Rheum,2000,43(4):821-826.











