孕激素和米非司酮对子宫内膜癌HHUA细胞的作用
【摘要】 目的 探讨孕激素和孕激素受体拮抗剂米非司酮对人子宫内膜癌HHUA细胞株的生长抑制作用及对其表达凋亡蛋白的影响。方法 体外培养人子宫内膜癌HHUA细胞,不同浓度孕激素和米非司酮分别作用于细胞72h,绘制细胞生长曲线半数有效浓度(IC50)后,分为对照组、孕激素组、米非司酮组、孕激素和米非司酮联合组,以各药物的IC50干预细胞48h后,用MTT法计算细胞抑制率,免疫组化S-P法测定各组细胞bcl-2和Fas蛋白表达的变化。结果 MTT实验表明,孕激素和米非司酮均能抑制子宫内膜癌细胞增殖。孕激素半数有效浓度为100.7537μmol/L;米非司酮的半数有效浓度为39.5534μmol/L,联合用药组抑制率显著高于单独用药组。孕激素和米非司酮联合可使bcl-2表达下降,Fas表达升高(P<0.05)。结论 孕激素和米非司酮联合应用在子宫内膜癌HHUA细胞的抗增殖和干预bcl-2和Fas蛋白的表达方面有协同作用。
【关键词】 子宫内膜肿瘤;孕酮;米非司酮;肿瘤细胞;培养
Effects of progesterone and mifepristone on the human endometrial cancer cell line HHUA
【Abstract】 Objective To study the effects of progesterone and mifepristone on the growth inhibitions and apoptosis protein of human endometrial cancer cell line.Methods HHUA cells,treated by different concentrations of progesterone and mifepristone were examined for their growth inhibitions with methyl thiazolyl tetrazolium(MTT) assay after 72 hours and got the inhibitory concentration 50%(IC50). HHUA cells,treated by control,progesterone or mifepristone or progesterone combined mifepristone for 48 hours,were examined for their inhibitory rate with MTT and for their bcl-2 and Fas with immunohistochemistry assay.Results HHUA cells growth was inhibited by progesterone and mifepristone.IC50 of progesterone is 100.7537μmol/L;IC50 of mifepristone is 39.5534μmol/L.The inhibitory rate of progesterone combined with mifepristone was obviously stronger than that of progesterone and mifepristone. The expression of bcl-2 was decreased and Fas increased(P<0.05). Conclusion HHUA cells was treated by progesterone combined with mifepristone and synergistic effect was observed on the inhibitory growth and the expression of bcl-2 and Fas.
【Key words】 endometrial neoplasms;mifepristone;progesterone;tumor cells;culture
近20余年来,子宫内膜癌的发病率有上升趋势,且随着发病年龄的年轻化,保留生育能力的方案已成为患者的迫切需求。激素治疗是年轻子宫内膜癌患者的主要保守治疗手段之一,研究显示[1],年轻未育的内膜癌Ⅰ期患者,如果细胞分化好可以考虑保守治疗,同时严密监测有无复发,等待完成生育后再行手术治疗。目前子宫内膜癌激素治疗的主要药物有高效孕激素及三苯氧胺。有研究表明,孕激素受体拮抗剂米非司酮对多种肿瘤细胞具有抑制作用。本实验旨在探索孕激素和米非司酮二者联合对子宫内膜癌HHUA细胞的生长抑制作用,以及该方案对HHUA细胞株表达凋亡蛋白的影响,以期为临床治疗子宫内膜癌提供新方案。
1 材料与方法
1.1 子宫内膜癌细胞系 子宫内膜癌HHUA细胞是高分化子宫内膜腺癌细胞,其含有雌二醇受体和孕激素受体以及wt p53、p21等基因,由山东省立生殖中心惠赠。
1.2 主要试剂和仪器 黄体酮分析纯购自江苏省药物检验所。米非司酮纯品由北京第三制药厂提供。DMEM细胞培养液(Gibco),小牛血清(杭州四季青),四甲基偶氮唑盐(MTT,Sigma公司),96孔培养板(Costar公司),酶联免疫检测仪(SPECTRAMAX 250型德国生产)。鼠抗人bcl-2、Fas单克隆抗体均为北京中杉公司产品。
1.3 细胞的制备 HHUA细胞在含10%小牛血清的DMEM培养液中置37℃、5%CO2培养箱中培养,每4~5天传代,药品用无水乙醇溶解,并用含小牛血清的培养基稀释到所需浓度,使乙醇终浓度小于1%。
1.4 四甲基偶氮唑盐(MTT)比色实验
1.4.1 绘制细胞生长曲线 取对数生长期HHUA细胞制备成3×104个细胞/ml,混匀后加入96孔细胞培养板,每孔200μl,24h后观察细胞已贴壁,吸弃上清加入含药物的培养基,孕激素的剂量稀释为0、10、20、40、60、80、100、120、140、160μmol/L,米非司酮的剂量稀释为0、5、10、20、40、60、80、100、120μmol/L,空白对照组中加入相等体积不含药物的培养基,每组6个复孔,培养72h,加MTT溶液(5mg/m)20μl,继续孵育4h,吸弃上清,每孔加入150μlDMSO,震荡10min,使结晶物充分溶解,选择490nm波长在酶联免疫检测仪上测定各孔吸光值,记录结果,按下列公式计算药物对肿瘤细胞的生长抑制率。抑制率=(AC-AT)/AC×100%。
AC为对照组吸光度值,AT为实验组吸光度值。以药物抑制百分率为纵坐标,药物浓度为横坐标,通过直线回归分别计算孕激素和米非司酮抑制50%肿瘤细胞时的有效浓度(IC50)(见图1),以IC50值作为干预细胞的药物浓度。
1.4.2 MTT法检验细胞增殖率 取对数生长期HHUA细胞制备成3×104个细胞/ml分别加入药物:对照组(加入与实验组等体积的培养液和溶解药物所用的等体积的无水乙醇)、P组(孕激素100.7537μmol/L)、RU486(米非司酮39.5534μmol/L)、P+RU486联合组(孕激素100.7537μmol/L+米非司酮39.5534μmol/L)。每组6个复孔,培养48h后,MTT法检测细胞增殖率。
1.5 免疫组织化学法
1.5.1 将处于对数生长期的HHUA细胞制备成1×105个细胞/ml的细胞悬液,在每孔底面铺有洁净小玻片的24孔培养板中每孔加入1ml,24h后待细胞贴壁后加入药物:对照组、P组、RU486组、P+RU486联合组,每个浓度设双孔,培养箱中继续培养48h,PBS冲洗2遍,用丙酮固定细胞玻片5~10min,严格按免疫组化操作程序进行S-P法染色。
1.5.2 染色结果判断 阳性表达为棕黄色颗粒的出现,其中bcl-2定位于细胞浆,fas定位于细胞膜。按AB值法进行光镜分析,A表示显色深浅:0分无显色,1分为浅黄色,2分为棕黄色,3分为棕色;B表示每个高倍镜视野棕色细胞所占比例:1分棕色细胞<1/3,2分棕色细胞1/3~2/3,3分棕色细胞>2/3,共记数5个高倍镜视野。每例细胞阳性表达积分(A×B)分为四级:“-”(阴性)积分为0分;“+”(弱阳性)积分为1~2分;“++”(阳性)积分3~4分;“+++”(强阳性)积分>4分。
1.6 统计学分析 数据分析采用SPSS11.5统计软件,所有数据结果均用x±s表示,组间多个样本均数间比较采用单因素方差分析。
2 结果
2.1 绘制细胞生长曲线 两种药物对肿瘤细胞的抑制率均随着药物浓度的增加而变化,存在明显的量效关系,P对HHUA细胞生长抑制的IC50为100.7537μmol/L,RU486的IC50为39.5534μmol/L(图1)。
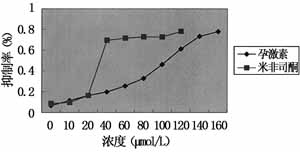
图1 MTT法检测P和 RU486对子宫内膜癌
HHUA细胞的抑制作用
2.2 孕激素和米非司酮联合对子宫内膜癌细胞的作用 细胞增殖实验显示,孕激素和米非司酮联合作用48h后细胞生长抑制率显著低于单独用药组(P<0.05)(表1)。
表1 孕激素和米非司酮对人子宫内膜癌HHUA细胞的抑制率

注:与对照组比较,*P<0.05;分别与孕激素和米非司酮组比较,△P<0.05
2.3 孕激素和米非司酮对凋亡蛋白表达的影响 免疫组化法测定bcl-2和Fas蛋白表达水平显示联合组分别与孕激素组和米非司酮组相比,bcl-2表达均显著下降(P<0.05),Fas表达显著上升(P<0.05)(表2)。
表2 孕激素和米非司酮作用48h Bcl-2,Fas蛋白表达变化 (x±s)
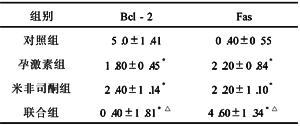
注:与对照组比较,*P<0.05;分别与孕激素和米非司酮组比较,△P<0.05
3 讨论
3.1 子宫内膜癌的激素 子宫内膜癌是妇科生殖道最常见的恶性肿瘤之一,目前在许多国家,内膜癌发病率已超过宫颈癌而跃居女性生殖道恶性肿瘤的首位。子宫内膜癌的病因目前尚不十分清楚,大部分研究认为子宫内膜癌最常见的发病高危因素是过量雌激素长期刺激的结果[2],雌激素刺激内膜过度增生,与内膜癌的发生关系密切。针对这一高危发病因素,许多临床和实验研究正积极探索内膜癌的激素治疗途径。目前,子宫内膜癌的孕激素疗法已被认可及应用,报道[3]孕激素治疗有效率为20%~25%,主要用于远处转移和复发的内膜癌患者,高分化且孕激素受体阳性的子宫内膜癌患者对激素治疗的反应率高,而雌激素受体拮抗剂三苯氧胺可以提高子宫内膜癌细胞表达孕激素受体。
3.2 孕激素对子宫内膜癌的作用 孕激素(progesterone)具有抑制肿瘤细胞增殖、调节细胞基因表达、抑制肿瘤细胞侵袭等作用。本研究中肿瘤细胞抑制实验的结果显示,孕激素对人子宫内膜癌HHUA细胞有很强的抑制作用,IC50为100.7537μmol/L。有研究显示孕激素对于孕激素受体阳性表达的子宫内膜癌细胞有生长抑制作用[4]。孕激素抗肿瘤作用机制表现在一方面诱导细胞周期素P21和P27产生,使细胞停滞于G1期[5],另一方面直接作用于内膜样腺癌细胞的血管内皮生长因子(VEGF)的基因转录,抑制内膜癌细胞的血管生成[6]。此外,有实验表明[7]安宫黄体酮可明显抑制MMPs的表达,这可能与孕激素抑制癌细胞浸润转移作用有关。孕激素用于治疗子宫内膜癌已有40多年的,对81例病理分期均为G1期的患者治疗结果显示,孕激素治疗后有62例患者出现反应,平均出现时间12周。其中15例病人复发,20例病人经完全治疗后妊娠。
3.3 米非司酮对子宫内膜癌的作用 孕激素受体拮抗剂米非司酮(RU486,mifepristone),由法国Roussel-Uclaf公司合成,最初在临床主要应用于终止早期妊娠,近年来已有人应用到多种妇科疾病和抗肿瘤治疗,包括乳腺癌、前列腺癌、卵巢癌、脑膜瘤、神经胶质瘤及子宫肌瘤[8~10]。RU486可通过抗孕激素、“非竞争性”抗雌激素和孕激素样作用等发挥抗肿瘤作用。本实验结果显示RU486具有很强的抑制肿瘤细胞生长的作用,其IC50为39.5534μmol/L。RU486抑制子宫内膜癌的研究虽已取得了一定的进展,但其抗肿瘤作用的分子学机制仍不十分清楚。Schneider等[11]用RU486处理三个子宫内膜癌细胞系,发现癌细胞增殖明显受抑制,并呈剂量依赖性。Aimin等[12]发现RU486能使Ishikawa细胞CASP3表达明显升高,凋亡细胞比率高于坏死,BCL/BAXmRNA比值下降,说明RU486可通过多种途径诱导细胞凋亡,抑制肿瘤细胞增殖。
3.4 孕激素和米非司酮联合对子宫内膜癌细胞的作用 Arango等[13]研究发现孕激素和米非司酮都可有效抑制子宫内膜癌细胞生长,且二者具有协同作用。笔者的研究结果支持这一观点,联合用药组和单独用药组相比,前者对肿瘤细胞生长的抑制率增高,免疫组化结果显示bcl-2表达下降和Fas表达升高,前者和后者相比有统计学意义,表明孕激素和米非司酮联合应用可能增强对凋亡蛋白的调节作用,诱导细胞凋亡,从而发挥抗肿瘤的协同作用。孕激素可抑制NF-KappaB的活性,控制细胞转录因子A20和ABIN-2[14],而Han等[15]研究证实米非司酮能够抑制NF-KappaB抑制物的激活,二者协同可能增强对肿瘤细胞基因转录的控制,促进细胞凋亡。此外,也有文献报道[16],孕激素可刺激内膜癌细胞血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF)基因转录,而孕激素与RU486合用可减弱孕激素对肿瘤血管的刺激作用,更好地发挥二者的抗肿瘤活性。
【文献】
1 Jadoul P,Donnez J.Conservative treatment may be beneficial for young women with atypical endometrial hyperplasia or endometrial adeno carcinoma.Fertil Steril,2003,80(6):1315-1324.
2 Sherman ME.Theories of endometrial carcinogenesis:a multidisciplinary approach.Mod Pathol,2000,13(2):295-308.
3 Markman M.Hormonal therapy of endometrial cancer.Eur J Cancer,2005,41(5):673-675.
4 Dai D,Kumat NS,Wolf DM,et al. Molecular tools to reestablish progestin control of endometrial cancer cell proliferation.Mol Cell Endocrinol,1999,150:11-21.
5 Dai D,Wolf DM,Litman ES,et al.Progesterone inhibits human endometrial carcinoma cell growth and invasiveness:down-regulation of cellular adhesion molecules through progesterone B receptors.Cancer Res,2002,62(3):881-886.
6 Mueller MD,Vigne JL,Pritts EA,et al.Progestins activate vascular endothelial growth factor gene transcription in endometrial adenocarcinama cells.Fertil Steril,2003,79(2):386-392.
7 Di NLA,Jobling T,Salamonsen LA.Progestin suppresses matrix metalloproteinase production in endometrial cancer.Gynecol Oncol,2003,89(2):325-333.
8 Ramirez PT,Frumovitz M,Bodurka DC,et al.Hormonal therapy for the management of grade 1 endometrial adenocarcinoma:a literature review.Gynecol Oncol,2004,95(1):133-138.
9 Li DQ,Wang ZB,Bai J,et al.Effects of mifepristone on proliferation of human gastric adenocarcinoma cell line SGC-7901 in vitro.World J Gastroenterol,2004,10(18):2628-2631.
10 Sridhar S,Ali AA,Liang Y,et al.Differential expression of members of the rumor necrosis factor alpha-velated apoptosis-inducing ligand pathway in prostate cancer cell.Cancer Res,2001,61(10):7179-7183.
11 Schneider CC,Gibb RK,Taylor DD,et al.Inhibition of endometrial cancer lines by mifepristone (RU486).J Soc Gynecol Investig,1998,56:334-338.
12 Aimin L,Juan C,Felix,et al.Effect of mifepristone on proliferation and apoptosis of Ishikawa endometrial adenocarcinoma cells. Fertil Steril,2005,84:202-211.
13 Arango H,Satyaswaroop P,Cavanagh D,et al.The growth inhibitory effects of onapristone and mifepristone (RU486) on the Ishikawa human endometrial cancer cell line.Gynecol Oncol,1996,62(3):423.
14 Davies S,Dai DH,Feldman I,et al.Identification of a novel mechanism of NF-ΚB inactivation by progesterone through progesterone receptors in Hec50co poorly differentiated endometrial cancer cells:induction of A20 and ABIN-2. Gynecol Oncol,2004,94:463-470.
15 Han S,Sidell N.R486-Induced growth inhibition of human endometrial Cancer cells involves the nuclear factor KappaB Signaling pathway.J Clin Endocrinol Metab,2003,88(2):713-719.
16 Mueller MD,Vigne JL,Pritts EA,et al.Progestins activate vascular endometrial growth factor gene transcription in endometrial adenocarcinoma cells. Fertil Steril,2003,79(2):386-392.











