胰腺移植的新进展
1 适应证
ESRD是胰腺移植的标准适应证,约占移植总数的94%。从理论上讲,为了将糖尿病相关并发症的危害控制到最低,减轻长期治疗下的昂贵负担,所有1型糖尿病患者均适宜于胰腺移植。对于糖尿病肾病,美国移植中心建议,当肌酐清除率(CCr)<40ml/min时实施胰肾联合移植(SPK);而在欧洲,基于对器官短缺等因素的考虑,大多数移植中心较严格地将CCr<20ml/min的患者列入胰腺移植的轮候名单[3]。Sollinger在1999年提出的适应证为:(1)肾衰竭(进展期糖尿病肾病或依赖于透析治疗,血肌酐>3mg/dl);(2)血清C肽浓度下降;(3)较低的心血管疾病风险[没有或轻微的冠心病(运动实验阴性)];(4)无糖尿病血管并发症,如截肢等;(5)有良好的对PT的心理顺应性;(6)能很好理解PT的复杂性,并能遵从移植后治疗方案。
SPK治疗2型糖尿病合并终末期肾病一度存在较大争议,但其成功病例不乏见报道,近年来,2型糖尿病接受胰腺移植的患者呈增多趋势。2001年2型糖尿病也被美国器官分享(UNOS)正式列为适应证之一。
2 手术方式
胰腺移植主要包括单独胰腺移植(pancreas transplantation alone,PTA)、肾移植后胰腺移植(pancreas after kidney transplantation,PAK)和胰肾联合移植(simultaneous pancreas?kidney transplantation,SPK)。SPK适用于患尿毒症或终末期前肾病(CCr<50ml/min)的糖尿病患者。通常胰和肾移植物来自同一个尸体供者,但也可以是尸体全胰和活体肾移植或活体节段胰和肾移植。在SPK受者中HLA的配型对移植胰的存活率的影响不是很大,但在PTA中HLA配型却显得很重要。SPK的优点还包括同时纠正了糖代谢紊乱和尿毒症;胰肾取自同一供体,抗原单一;只需一次手术和一次大剂量免疫抑制剂治疗;移植胰的早期排斥反应可通过移植肾来监测;胰肾免疫保护作用和移植成功率高,移植胰的1年存活率为83%[4]。SPK阻止了移植肾糖尿病肾病的复发,移植肾存活率较单纯肾移植高,所以全世界迄今为止已实施的胰腺移植中约90%采用该术式[5]。PAK是患者先前接受了肾移植(尸体或活体来源)后再移植胰腺,其胰腺和肾移植物分别来自2个供者。PTA受者一般是患尿毒症前的型糖尿病患者,这些患者的糖尿病并发症(增殖型糖尿病视网膜病、自发性糖尿病肾病和微蛋白尿)通常很快,呈进行性恶化,且易频繁发生低血糖性昏迷,故胰腺移植对他们来说虽然会出现长期免疫抑制治疗的不良反应,但其生活质量还是明显改善了。
2.1 胰腺外分泌处理方式 目前临床上应用的胰腺外分泌引流术式主要为膀胱外引流(bladder drainage,BD)和空肠内引流(enteric drainage,ED)两种。一般认为BD术式操作方便,近期并发症少,其最明显的优点在于可随时测定尿液淀粉酶的变化而早期诊断排斥反应。然而,BD术式的远期并发症较多,如泌尿系感染、出血、胰液的丧失造成代谢性中毒及脱水。部分患者无法耐受这些泌尿系统和代谢问题的困扰而再次手术改行ED[6]。最近一组报告揭示,BD术后平均15.7个月内改行ED者占15.4%[7]。Wisconsin大学对肠道和膀胱这两种引流方式术后的并发症进行了对比研究,结果显示,泌尿道感染发生率分别为16.0%和67.0%,尿道狭窄、血尿等其他泌尿系并发症的发生率分别为0和20.0%,胰瘘的发生率分别为5.0%和18.0%,腹腔内感染的发生率分别为12.1%和16.4%,胰腺炎的发生率分别为7.3%和3.6%[1]。随着外科手术技术的成熟,ED术式操作并无困难,术后早期并发症并不高于BD术式。尤其在SPK术后,可通过血清肌酐的上升等指标监测排斥反应,胰腺外分泌能力的变化并非是不可缺的指标,因而近年来多数中心以ED术式作为胰腺外分泌引流的主要方式[8]。
2.2 胰腺内分泌处理方式 静脉回流的处理方法主要有经门静脉系统回流(portal venous drainage,PV)和经体循环回流(systemic venous drainage,SV)两种术式,目前国际上使用较多的是SV术式,但该术式是胰岛素直接回流入体循环,未经肝脏代谢,可造成高胰岛素血症,长期高胰岛素血症可引起高脂血症和高胆固醇血症,并可造成动脉硬化。因SV的方式更符合生理,近年来引起了较多的重视。一项回顾性分析显示,PV组移植胰腺的生存率高于传统的SV组,而急性排斥反应发生率则低于后者[9]。然而,最近对UNOS登记的6629例SPK术的回顾性分析显示胰腺内分泌经门静脉引流并无任何潜在的免疫学方面的优势[10]。这些争议提示,对胰腺内分泌的引流方式仍需要进行严格的前瞻性随机对照研究。
3 排斥反应
众所周知,内源性胰岛素水平下降和血糖升高出现相对较晚,对早期诊断和阻止排斥反应常常很困难,临床征象如发热、移植部位触痛、腹痛等均不能特异性地诊断为排斥反应。病诊断仍不失为金标准。移植胰腺排斥反应的组织学分级及特点[1],见表1。
表1 移植胰腺急性排斥反应的组织学分级
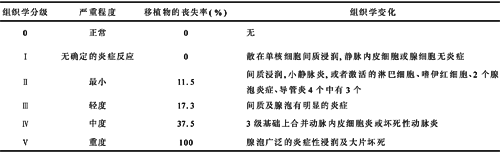
3.1 排斥反应诊断方面的进展 (1)胰腺排斥时首先受累的是腺泡,接着依次是导管、血管、胰岛,腺泡细胞破坏后释放出胰酶,血清胰特异性酯酶较基础值升高2倍以上,比活检证实排斥反应早2~3天,经抗排斥反应治疗后其值降至正常,对早期诊断胰腺排斥反应有重要的价值,且有较高的组织特异性。(2)胰腺急性排斥反应时将伴随着大量的细胞因子的产生,这些细胞因子在招引淋巴细胞浸润移植物、激活淋巴细胞及介导免疫系统对移植物的破坏上发挥着重要的作用。国内李靖、张雷等[11,12]认为T细胞亚群、IL-2及TNF-α均参与了胰十二指肠移植排斥反应过程,提出动态监测TNF-α及T细胞亚群的变化有助于预测及早期诊断移植胰腺排斥反应。(3)凋亡是介导急性排斥反应引起移植物损伤的重要机制,NO可以作为细胞毒性分子介导急性排斥反应时移植物细胞凋亡。国内李为苏等[13]提出血清NO可用于监测胰腺急性排斥反应,指导适时进行胰腺活检早期诊断。(4)近年来,随着对热休克蛋白-70(HSP70)研究的不断深入,发现其在移植免疫应答中起着始动作用,起到MHC分子样作用。在胰、十二指肠移植后,HSP70表达水平明显升高,而且与排斥反应的组织学表现相一致,有着重要的临床意义,检测HSP70在移植胰中的表达对急性排斥反应的早期诊断有一定价值[14]。
3.2 急性排斥反应与慢性排斥反应 急性排斥反应与慢性排斥反应两者之间有着密切的联系,大多数慢性排斥反应都是由急性排斥反应发展而来的。尽管有的患者一开始就表现为慢性排斥反应,但病理检查大多可以发现急性排斥反应的存在,只是没有出现临床症状。在以下情况中,急性排斥反应易发展为慢性排斥反应:(1)急性排斥反应发生的次数较多;(2)第一次急性排斥反应出现的时间晚;(3)激素不能逆转的急性排斥反应;(4)血管性排斥反应较间质性排斥反应易发展为慢性排斥反应;(5)急性排斥反应的病理分级越高,慢性排斥反应的发生率越高[15]。
4 免疫抑制剂应用的现状
胰腺移植术后免疫抑制剂的使用方案和其他实质性脏器移植基本一致。目前,全球绝大多数移植中心均采用标准的四联免疫疗法[16],即单克隆或多克隆抗淋巴细胞抗体、他克莫司(TAC)、酶酚酸酯(MMF)和激素(快速减量)。Wisconsin大学的方案为:舒莱(Simulect)20mg×2天或赛尼哌(Zenapax)1mg/kg×5天或2mg/kg×2天或多克隆抗体(Thymoglobulin)1.5mg/kg×10天;MMF 2mg/d静脉滴注直至能口服;TAC 8mg/d,于血肌酐≤255.5μmol/L开始使用,调整血药浓度至10~15ng/ml;激素术中500mg,术后第1和第2天分别为250mg,以后每天30mg[1]。
5 并发症及其防治
近年来胰腺移植迅速,但其移植效果不如肾、肝、心移植,主要是因为其并发症较多。SPK的并发症仍是引起术后高病残率的主要原因[17]。SPK术后的外科并发症总发生率为30%~40%,再手术率高达32%~38%,其中术后3个月内需再手术的外科并发症包括移植物血栓形成(6%~17%)、腹腔内感染(1%~5%)、吻合口漏(0.5%~2%)以及出血(0.5%)[5]。胰腺移植术后血栓形成是导致移植物功能丧失的主要原因之一,而且常需行急诊移植胰切除,其发生率在10%~20%[18],Foshager等[19]报道SPK术后移植物血栓形成发生时间平均3.5(0~12)天,其中55发生在术后第1天。胰腺移植术后血栓形成的主要原因有:(1)糖尿病造成血液系统紊乱;(2)移植后缺血再灌注损伤;(3)移植胰腺是相对低血流量器官,脾静脉回流血量较少;(4)血管吻合技术。预防方法主要有选择损伤小的灌注液(UW液)、缩短冷缺血时间、预防性使用抗凝药物(常用的为肝素)、术后卧床休息、完善切取移植技术,其中预防性使用抗凝药物是预防血栓形成的关键。移植后胰腺炎是胰腺移植常见并发症之一,约有7%的移植物功能丧失由它所致。发生的原因主要与保存及缺血再灌注损伤有关,其机制与细胞内钙超载、氧自由基产生、内皮素及NO分泌不平衡直接导致腺泡损害、胰酶激活、循环障碍等有关。主要应用生长抑素。胰周感染也是重要的早期并发症,是由微生物侵入腹腔而引起的。术后7~14天病人持续出现肠梗阻表现、发热、腹痛、白细胞升高和肌紧张时,应考虑胰周感染的可能。其治疗主要包括腹腔灌洗,胰周坏死脂肪组织的彻底清除及适当应用抗生素。胰周感染一般很少由十二指肠膀胱吻合口瘘或十二指肠小肠吻合口瘘引起,一旦产生瘘,应尝试行吻合口修补术。另外,Wullstein等[18]研究发现SPK后C反应蛋白(CRP)的水平与胰腺相关并发症有一定联系,排除术后出血后,需再次手术患者、移植胰胰腺炎患者和胰腺功能丧失患者的CRP峰值增高,但移植排斥率、死亡率和肾脏丧失率无差别,因此,临床上CRP水平高的SPK受者极有可能产生胰腺相关并发症,应该引起高度重视。Heredia等[20]报道11例并发十二指肠瘘的病人中6例由急性排斥反应引起,3例由巨细胞病毒(CMV)感染引起,2例由外科技术问题引起,故认为急性排斥反应和CMV感染是引起十二指肠瘘的主要原因,有效地控制急性排斥反应和CMV感染可以预防十二指肠瘘。抗磷脂综合征(APLS)可能是SPK移植物血栓的一个危险因素,移植前筛查APLS可能有益处[21]。对急性胰腺炎的预防和治疗可使用生长抑素。密切观察胰腺内外分泌功能是预防并发症的关键。
6 胰腺移植与胰岛移植
自加拿大成功地报道了胰岛细胞移植后。最近又报道了20例病人接受胰岛细胞移植后1年不依赖胰岛素者达80%[22]。然而该成果的取得是建立在每位受者需要2~3个尸体供者的基础上,其中远期效果尚未知,Shapiro等[23]已经报道了37例患者中2例门静脉血栓和3例肝脏出血等并发症。另外,胰岛细胞移植不可避免地会发生慢性移植物功能不全,最终可能需要频繁地再次移植来维持不依赖胰岛素的状态,而且目前尚无有效的方法来早期诊断其排斥反应。胰岛移植暂时根本无法取代胰腺移植。但随着分子生物技术和相关学科的进展,如细胞混合培养、转基因技术、B细胞株的建立等一系列方法的兴起,基础及临床研究的协作加强,胰岛移植仍然有很好的前景。
【】
1 Odorico JS,Sollinger HW.Technical and immunosuppressive advances in transplantation for insulin dependent diabetes mellitus.World J Surg,2002,26(2):194-211.
2 Miyamoto M.Current progress and perspectives in cell therapy for diabetes mellitus.Hum Cell,2001,14(4):293.
3 Becker BN,Odorico JS,Becker YT,et al.Simultaneous pancreas?kidney and pancreas transplantation.J Am Soc Nephrol,2001,12(11):2517.
4 Mamode N,Sutherland DE.Transplantation for diabetes mellitus.Br J Surg,2003,90(9):1031-1032.
5 Sutherland DE,Gruessner RW,Dunn DL,et al.Lessons learned from more than 1,000 pancreas transplants at a single institution.Ann Surg,2001,233(4):463.
6 Adamec M,Janousek L,Lipar K,et al.A prospective comparison of bladder versus enteric drainage in vascularized pancreas transplantation.Transplant Proc,2004,36:1093-1094.
7 Perosa M,Genzini T,Caravatto PP,et al.Enteric conversion after bladder drained pancreas transplantation experience of 14 cases.Transplant Proc,2004,36:978-979.
8 Linde P,Boog PJ,Baranski AG,et al.Pancreas transplantation:advantages of both enteric and bladder drainage combined in a two?step approach.Clin Transplant,2006,20(2):253-257.
9 Philosophe B,Farney AC,Schweitzer EJ,et al.Superiority of portal venous drainage over systemic venous drainage in pancreas transplantation:a retrospective study.Ann Surg,2001,234:689-696.
10 Troppmann C,Gjertson DW,Cecka JM,et al.Impact of portal venous pancreas graft drainage on kidney graft outcome in simultaneous pancreas?kidney recipients reported to UNOS.Am J Transplant,2004,4:544-553.
11 李靖,梁平,杨勇,等.T细胞亚群、IL-2a变化与猪全胰十二指肠移植排斥反应的关系.肝胆外科杂志,2006,14(1):59-61.
12 张雷,秦新裕.小鼠异种胰岛移植排斥反应研究.中华实验外科杂志,2006,23(1):43-44.
13 李为苏,罗开,石群立,等.胰腺移植急性排斥反应的监测.解放军医学杂志,2001,26(8):581-582.
14 Ni Xiaoguang,Liu Zhong,Chen Hailon,et al.The relation between apoptosis of acinar cells and nitric during acrte rejection of pancreas transplantation in rats.Transplant Immology,2003,11:15-21.
15 Matas AJ.Acute rejection is a major risk factor for chronic rejection.Transplantation Proceedings ,1998,30:1766-1768.
16 Lo A,Stratta RJ,Alloway RR,et al.Initial clinical experience with interleukin-2 receptor antagonist induction in combination with tacrolimus,mycophenolate mofetil,and steroids in simultaneous kidney?pancreas transplantation.Transpl ant Int,2001,14(6):396-404.
17 Kahl A,Bechstein WO,Frei U.Trends and perspectives in pancreas and simultaneous pancreas and kidney transplantation.Curr Opin Urol,2001,11(2):165.
18 Wullstein C,Drognitz O,Woeste G,et al.High levels of C?reactive protein after simultaneous pancreas?kidney transplantation predict pancreas graft?related complications and graft survival.Transplantation,2004,77(1):60-64.
19 Foshager MC,Hedlund LJ,Troppmann C,et al.Venous thrombosis of pancreas transplants:diagnosis by duplex sonography.Ajr Am J Roentgenol,1997,169:1269.
20 Heredia EN,Ricart MJ,Astudillo E,et al.Pancreas transplantation with enteric drainage:duodenal segment leak.Transplant Proc,2002,34:215.
21 Wullstein C,Woeste G,Zapletal C,et al.Simultaneous pancreas?kidney transplantation in patients with antiphospholipid syndrome.Transplantation,2003,75(4):562-563.
22 Shapiro AM,Lakey JR,Ryan EA,et al.Islet transplantation in seven patients with type 1 diabetes mellitus using a glucocorticoid?free immunosuppressive regimen.N Engl J Med,2000,343( 4):230-238.
23 Shapiro AM,Ryan EA,Lakey JR.Pancreatic islet transplantation in the treatment of diabetes mellitus.Best Pract Res Clin Endocrinol Metab,2001,15(2):241-264.











