Erk1/2信号通路在EGCG抑制MGC-803细胞增殖中的作用
【关键词】 EGCG; 胃肿瘤; c-Myc; Erk1/2
【Abstract】 Objective To probe the effects of green tea extract epigallocatechin-3-gallate(EGCG) on proliferation of human gastric cancer cell line MGC-803 and its molecular mechanisms. Methods MTT assay was used to test the inhibitory effects of EGCG on proliferation in MGC-803 cells. Expression of c-Myc in MGC-803 cells was detected by immunocytochemistry.The expression of phosphorated Erk1/2 protein in MGC-803 cells was examined using Western blot analysis.Results MTT assay has shown that EGCG significantly inhibited proliferation of MGC-803 cells in a concentration dependent manner.Immunocytochemistry detected the expression down regulation of c-Myc protein analysis treated with EGCG for 48 hours in MGC-803 cells.Western blot analysis confirmed the expression of phosphorylated Erk1/2 protein significantly down regulated.Conclusion EGCG inhibits proliferation of MGC-803 cells in a concentration dependent manner and its mechanism associated with the down regulation of c-Myc and phosphorylated Erk1/2 proteins expression.
【Key words】 EGCG;gastric neoplasm;c-Myc;Erk1/2
近年来,研究开发天然植物药抗肿瘤已成为有前景的新领域,并取得了可喜成绩,如:羟基喜树碱、三尖杉酯碱等对肿瘤细胞有明显抑制作用,并已研制出用于临床的制剂[1,2]。茶是一种由山茶科植物的叶片经一定的工艺制作成的饮料。研究发现绿茶及其提取物具有清除氧自由基、抗氧化、抗突变、抗炎抗病毒和抑制肿瘤生长等众多功效[3~5]。流行病学调查表明常饮绿茶与肿瘤的低发生率有关[6]。表没食子儿茶素没食子酸酯(epigallocatechin-3- gallate,EGCG)是绿茶的主要成分之一。本试验观察EGCG对人低分化胃腺癌MGC-803细胞株生长的影响,初步探讨EGCG抑制胃癌细胞增殖的分子机制。
1 材料与方法
1.1 药品试剂 EGCG(Sigma公司产品,纯度95%)购自北京鼎国生物技术有限责任公司,EGCG用磷酸盐缓冲液溶解,配成5mg/ml,0.22μm微孔滤膜抽滤除菌,4℃保存;培养基RPMI-1640(Gibco公司产品);小牛血清(杭州四季青生物工程公司产品);c-Myc抗体、S-P试剂盒、DAB试剂盒均购自福州迈新公司(美国MAXIN公司产品);Erk1/2抗体、磷酸化Erk1/2抗体购自基因公司(Santa Cruz公司产品)。
1.2 细胞培养 人胃癌MGC-803细胞株,由中南大学湘雅医学院肿瘤所引进,系山东师范大学培育的人胃低分化黏液腺癌。本所保种、传代,培养基为RPMI-1640,抽滤除菌,临用前加10%小牛血清,细胞培养于37℃、5%体积分数CO2培养箱中。
1.3 MTT法测定细胞增殖抑制作用 取对数增长期细胞,消化后调整细胞密度至3×104/ml,96孔板每孔种细胞悬液180μl,6h后加不同浓度EGCG(20μl),试验设5个不同浓度组(终浓度为100μg/ml、80μg/ml、60μg/ml、40μg/ml、20μg/ml),调零组和空白对照组加等体积PBS,加药后继续培养48h,每孔加MTT(5mg/ml)20μl,调零组不加MTT。共同孵育4h后,吸尽培养板内液体,每孔加DMSO 150μl,震摇10min,置酶联免疫检测仪测定A570值。
1.4 免疫细胞化学 取对数生长期细胞常规消化后接种于含灭菌盖玻片的六孔板中,培养6h后加入处理因素(EGCG终浓度60μg/ml),培养48h,取出贴附细胞的盖玻片,按照S-P试剂盒说明操作。依次进行固定,过氧化物酶阻断,非免疫动物血清封闭,孵育一抗,孵育二抗,DAB显色,苏木素衬染,酒精梯度脱水,中性树胶封片。
1.5 免疫印迹 细胞培养后用悬浮裂解液于冰上裂解细胞,10000r/min离心10min,取上清液,BCA蛋白定量试剂盒调整蛋白至相同浓度。样品加入等体积2×SDS加样缓冲液,沸水煮沸5min,经SDS-PAGE胶电泳后转膜;封闭液封闭2h;加一抗(用封闭液稀释),4℃孵育过夜;TBST洗3次,每次15min;加相应的二抗(封闭液稀释),室温孵育1h,TBST洗3次,每次15min;用ECL发光法检测蛋白表达状况。免疫印迹所用试剂(悬浮裂解液、SDS加样缓冲液、封闭液、TBST均参照《分子克隆》配制)。
2 结果
2.1 MTT比色法测定EGCG对MGC-803细胞增殖的影响 EGCG抑制MGC-803细胞增殖,呈浓度依赖性。实验结果采用方差分析进行统计学处理。EGCG各浓度处理组与空白对照组比较,差异均有显著性(P<0.05)。数据见表1。根据公式IC50=58.60μg/ml。
表1 EGCG对MGC-803细胞增殖的影响 (48h,n=6)
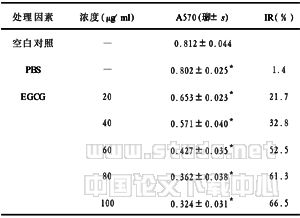
注:与空白对照组比较*P<0.05
2.2 免疫细胞化学检测EGCG对MGC-803细胞c-Myc表达的影响 见图1。c-Myc蛋白表达阳性的细胞其胞核为棕黄色,胞核蓝色的为c-Myc表达阴性的细胞。从图1可以看出:空白对照组大部分细胞c-Myc表达阳性,而经EGCG处理后仅少数细胞表达c-Myc。每组爬片不同部位观测5个视野,每视野计数100个细胞,统计其阳性率。EGCG空白对照组c-Myc阳性表达率为81.3%,EGCG(60μg/ml)处理组c-Myc阳性率为18.2%,两组之间经单向方差分析P<0.05,差别具有统计学意义。
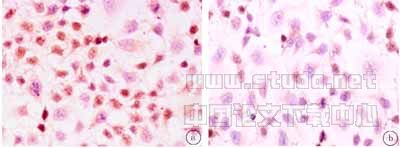
a .PBS,48h,MGC-803,c-Myc,S-P×200 b .EGCG,48h,MGC-803,c-Myc,S-P×200
图1.免疫细胞化学检测c-Myc蛋白
2.3 免疫印迹检测Erk1/2蛋白的磷酸化水平 以总Erk1/2蛋白作为内对照。EGCG(60μg/ml)处理MGC-803细胞,随着处理时间的延长,Erk1/2的磷酸化水平逐渐减弱;不同浓度EGCG(40μg/ml、60μg/ml、80μg/ml、100μg/ml)处理MGC-803细胞48h,磷酸化Erk1/2蛋白随EGCG浓度的增大表达逐渐减弱。以总Erk1/2蛋白为内对照,总Erk1/2蛋白的表达不随EGCG处理时间及浓度的改变而发生变化。见图2。
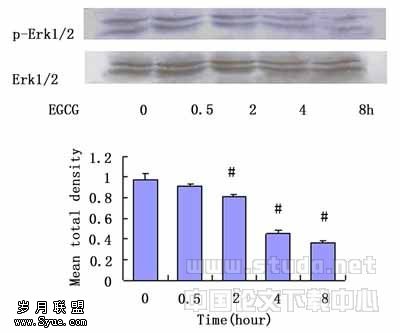
图2a. EGCG对MGC-803细胞Erk1/2蛋白磷酸化水平的影响(60?g/mL,不同时间)
#:与0h组相比,P <0.05(n=3)
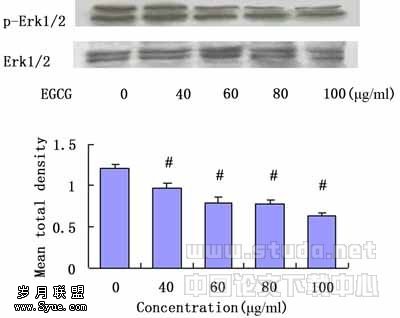
图2b. EGCG对MGC-803细胞Erk1/2蛋白磷酸化水平的影响(不同浓度,48h)
#:与0?g/mL组相比,P<0.05(n=3)
3 讨论
胃癌在我国的发病率与死亡率仍居消化道恶性肿瘤之首,严重危害人民的健康与生命。目前,胃癌的有效方法仍以根治性外科手术为主,早期胃癌根治性切除后5年生存率可达90%以上,但目前我国就诊的胃癌患者中大多数属中晚期,手术切除率仅为50%左右,而术后5年生存率仅有20%~30%[7,8]。胃癌的发生、与饮食因素关系密切。因此,寻找天然植物药对预防胃癌的发生、发展以及治疗具有重要的研究价值和广阔的应用前景。本实验运用MTT比色法检测EGCG对人胃癌MGC-803细胞增殖的影响。结果显示,EGCG显著抑制MGC-803细胞增殖,EGCG(20μg/ml、40μg/ml、60μg/ml、80μg/ml、100μg/ml,48h)处理MGC-803细胞,其抑制率分别为21.7%、32.8%、52.5%、61.3%、66.5%。各浓度处理组与空白对照组比较差异均有显著性(P<0.05)。证实EGCG对MGC-803细胞增殖有明显的抑制作用,且呈浓度-效应依赖关系。细胞增殖是由外界增殖信号作用于膜受体或胞浆受体,经信号传导系统传递增殖信息,调控细胞的转录与翻译,从而影响细胞周期的结果。Erk信号通路是主要的促进细胞增殖和分化的信号途径,其主要功能是介导有丝分裂信号向细胞核传递,调控细胞的生长,还可能参与细胞分化、转化、细胞周期等生命活动的调节[9]。本实验发现EGCG具有抑制Erk1/2磷酸化的作用。Erk途径的经典通路为RPTK-Ras-Raf-MEK1/2-Erk1/2,即细胞因子与相应受体结合后能通过膜上的蛋白酪氨酸受体将信号传给Ras,Ras发生膜转位并激活丝氨酸/苏氨酸激酶Raf,然后通过MEK使Erk1/2活化,后者转位至核内激活多种转录因子,刺激c-fos、c-Myc等原癌基因及周期蛋白的表达,引起细胞增殖[10]。c-Myc是一类编码核转录因子的癌基因,在细胞增殖、分化与细胞凋亡中起着重要作用[11]。c-Myc与某些人类肿瘤关系密切,它可能通过染色体异位而被活化。Myc蛋白在胞内的功能形式是与Max形成异源二聚体;Max具有较强的DNA结合能力,而Myc的N端具有转录活性区,Myc的过度表达可刺激相关基因的转录而有助于细胞的增殖及肿瘤的形成[12]。免疫组化证实EGCG能下调c-Myc蛋白在MGC-803细胞中的表达。Erk1/2的活化是该通路中的一个重要环节,而阻断Erk1/2活化能影响细胞的增殖。本实验证实EGCG能够抑制MGC-803细胞增殖,其抑制增殖作用与抑制Erk1/2蛋白磷酸化,下调c-Myc蛋白表达有关。提示EGCG可能通过抑制Erk1/2信号通路发挥抑制肿瘤细胞增殖的作用。然而对其他肿瘤细胞是否具有相同的作用,有待进一步研究。
【】
1 杨眉,曾裕建.喜树碱及其衍生物的研究进展.医药卫生,2003,19(8):977-978.
2 李荣,刘晓力.三尖杉酯碱诱导K562细胞凋亡的蛋白质组研究.中华血液学杂志,2004,6:323-327.
3 Madhumita R,Sutapa C,Dona S,et al.Anticlastogenic,antigenotoxic and apoptotic activity of epigallocatechin gallate:a green tea polyphenol.Mutat Res,2003,523-524:33-41.
4 Joshua D Lambert,Chung SY.Cancer chemopreventive activity and bioavailability of tea and tea polyphenols.Mutat Res,2003,523-524:201-208.
5 Heidi C,Lian-Ying W,Chinpal K,et al.Is the cancer protective effect correlated with growth inhibitions by green tea-epigallocatechin gallate mediated through an antioxidant mechanism?Cancer Lett,2001,162:149-154.
6 Y Tsubono,Y Nishino,S Komatsu,et al.Green tea and the risk of gastric cancer in Japan.New Engl J Med,2001,344:632-636.
7 李振洪.胃癌化学药物治疗现状与展望.华夏医学,2001,14(2):246-247.
8 Murad MA,Santiago FF,Petroiunu A,et al. Modified therapy with 5-fluorouracil, doxorubicin,and methotrexate in advanced gastric cancer.Cancer,1993,72:37-41.
9 Viala E,Pouyssegar J.Regulation of tumor cell motility by ERK mitogen-activated protein kinases. Ann N Y Acad Sci,2004,1030:208-218.
10 Lim JH,Lee ES,YOU HJ,et al. Ras-dependent induction of HIF-1 alpha785 via the Raf/MEK/ERK pathway: a novel mechanism of Ras-mediated tumor promotion. Oncogene, 2004,23:9427-9431.
11 Kabilova TO, Chernolovskaya EL, Vladimirova AV,et al. Silencing of c-Myc expression in tumor cells by siRNA. Nucleosides Nucleotides Nucleic Acids,2004, 23(6-7):867-872.
12 鄂征,癌变机理研究.北京:北京出版社,1999,263.











