缺血预处理对大鼠肝移植缺血再灌注损伤后CyclinD1和CyclinE表达的影响
作者:裴旭东,叶启发,肖建生,明英姿,牛 冰
【摘要】 目的 探讨缺血预处理(IP)对大鼠肝移植缺血再灌注(IR)损伤后肝CyclinD1和CyclinE表达的影响,以了解移植肝再生能力和功能不良的影响因素。方法 将SD大鼠90只随机分为缺血预处理组(IP组)、对照组(OLT组)和假手术组(SO组)3组;用全自动生化分析仪来检测肝功能;通过免疫组化S-P法来测定移植肝CyclinD1和CyclinE的变化。结果 对照组中大鼠移植肝缺血再灌注损伤后血清中丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)明显升高,CyclinD1和CyclinE的百分含量较低,提示移植肝细胞再生不良;实验组经缺血预处理后血清中ALT、AST稍升高,幅度<对照组,CyclinD1和CyclinE的百分含量很高,提示移植肝细胞再生活跃。结论 缺血预处理能够启动内源性保护移植肝的相应机制,可促进肝CyclinD1和CyclinE的合成,激发肝细胞的增殖和再生。
【关键词】 大鼠肝移植;缺血再灌注;缺血预处理;CyclinD1;CyclinE
【Abstract】 Objective To approach expressed influence of CyclinD1 and CyclinE in period of ischemia-reperfusion(IR) post injury of liver transplant by ischemia-pretreatment (IP) in rat, with a view to comprehend influence factor of transplanted liver regeneration capacity and dysfunction.Methods Ninety SD rats were randomly divided into three groups:ischemia-pretconditioning group (IP group),control group (OLT group) and sham operation group (SO group);to detect hepatic function by automatic biochemistry analyzer;to determine changes of CyclinD1and CyclinE of transplanted hepatic cell by immunity histochemistryS-P method.Results Serum ALT,AST obviously stepped up of control group rat of transplanted liver ischemia-reperfusion postinjury, percent content lied low comparatively;to hint dysregerated of transplanted hepatic cell.Serum ALT, AST sightly heighten, and content little to control group,in experiment group rat of being ischemia-pretconditioned, percent content express quite hight,to hint transplanted hepatic cyothesis active.Conclusion Ischemia- pretconditioned can switch on corresponding mechanisms of endogenous conserve transplanted liver,be able to promote synthesis of CyclinD1and CyclinE,to stimulate hepatocelluar multiplication and regeneration.
【Key words】 rat transplanted;ischemia-reperfusion;ischemia-pretconditioning;CylinD1;CyclinE
缺血再灌注(IR)损伤普遍贯穿于肝移植始终,它是临床上肝移植术后原发性移植物无功能的首要因素。Sasaki等证实IR损伤可使鼠移植肝细胞凋觯?],近年来的研究也表明肝脏再生能力的大小也是IR损伤后移植肝功能恢复的关键环节。缺血预处理(IP)是公认的对肝脏IR损伤有保护作用[2]。为研究移植肝IR损伤程度与肝细胞再生能力的关系,本实验以移植肝IR损伤后CyclinD1和CyclinE的表达作为细胞增殖指标,以检测IP对IR损伤后移植肝细胞增殖的影响,从而进一步探讨肝移植术后肝功能不良的原因。
1 材料与方法
1.1 实验动物与分组 纯系Wistar雄性大鼠90只,体重280~320mg,由湖南农业大学实验动物研究中心提供。普通喂养,自由进食,术前12h禁食,将大鼠随机分为3组:(1)取样缺血预处理组(IP组):即在供肝冷转灌注前缺血处理10min,10min再灌注,循环2次,然后行双袖套法原位肝移植术。术后2h、6h、24h各时间点取肝脏标本和经下腔静脉采血4ml待测。各时间点分别取样6只。(2)对照组 (OLT组):即单纯行双袖套法原位肝移植术,术后2h、6h、24h各时间点取肝脏标本和经下腔静脉采血4ml待测。各时间点分别取样6只。(3)假手术组(SO组):即血流阻断与复流及原位肝移植外,其余处理同上。分别取样6只。
1.2 实验器械与试剂 肝功能检测用全自动生化分析仪(AU800 Olympus)。免疫组化试剂CyclinD1单克隆抗体(兔抗大鼠),购于北京中杉金桥生物技术有限公司;CyclinE单克隆抗体(兔抗大鼠),购于上海长岛生物技术有限公司;DAB显色试剂购于福州迈新生物技术有限公司。
1.3 方法
1.3.1 原位肝移植模型的建立 按照Kamada[3]和孙君泓[4]报道的术式建立大鼠原位肝移植模型:即不重建肝动脉的双袖套法大鼠肝移植术。
1.3.2 标本的制备和测定方法 取移植肝组织用4%的复合甲醛固定待制石蜡标本,行光镜学检查及行免疫组化S-P法检查,同时将所采静脉血2ml,11000r/min离心5min取血清置于-70℃深低温水箱保存检测转氨酶。
1.4 结果判断标准 由两位病理医生在光镜200倍视野下,每张切片取5个视野,用HPIAS—1000型彩色图像分析仪系统测定CyclinD1和CyclinE表达情况,结果用阳性细胞率来表示:阳性细胞率(%)=视野中阳性细胞数/视野中总细胞数× 100%。
1.5 统计学方法 所有数据以均数±标准差(x±s)来表示,以SAS统计软件包分析处理,多个样本均数间比较用重复测量设计方法分析和单因素方差分析,IP组与OLT组比较用t检验。
2 结果
2.1 一般情况 该部分供肝手术时间、血管袖准备时间和受体手术时间分别为(30±3.30)min、(11±3.83)min和(31.5±3.20)min。其中无肝期为18~22min,平均(19.67±1.63)min,手术成功率94.1%。未处死的大鼠1周存活率达88%,最长存活72天。
2.2 各组血清ALT、AST含量 见表1。OLT组各时间点ALT、AST较SO组显著升高,且随再灌注时间延长而逐步升高,以移植肝再灌注2h升高最为明显,以后升高幅度降低。IP组各时间点ALT、AST升高幅度远低于OLT组,与之相比较,P<0.01。
2.3 移植肝细胞周期蛋白CyclinD1、CyclinE标记阳性细胞率 SO组CyclinD1、CyclinE均未发现阳性表达。IP组各时间点CyclinD1、CyclinE阳性细胞率均高于OLT组,尤以6~24h升高明显;而IR组6h细胞凋亡显著升高,增殖低下,24h仍维持很低水平。24h CyclinD1与CyclinE阳性细胞率分别为0.47±0.23、0.44±0.21与OLT组0.21±011、0.20±0.08比较,差异具有非常显著性(t=7.57,P<0.01),见表2。笔者还发现CyclinD1表达时限等同于CyclinE的表达,阳性细胞表达率高于CyclinE的表达率。
表1 移植肝IR损伤后血清ALT、AST含量变化 (x±s,u/L)
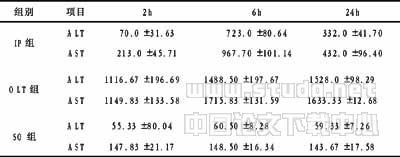
注:同时间点IP组与OLT组相比较,P<0.01
表2 移植肝IR后细胞周期蛋白CyclinD1、CyclinE阳性细胞率表达 (x±s)
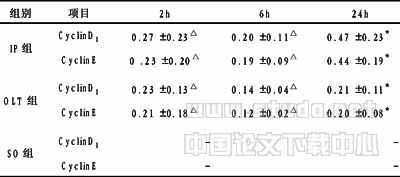
注:IP组与OLT组相比较,△P<0.05;IP组与OLT组相比较,*P<0.01
2.4 光镜下肝脏病理组织学变化与SO组肝脏组织相比较 OLT组(见图1、图2)中肝脏细胞广泛水肿,以中央静脉周围为主,肝组织结构混乱可见小滴样脂肪变性,肝窦内大量中性粒细胞浸润;灌注后24h可见部分肝窦狭窄,并有红细胞残片,界板破坏。而IP组(见图3、图4)仅有轻度肝细胞水肿,肝窦内有少许中性粒细胞散在,小叶结构基本完整。
3 讨论
IR引起损伤已在多种组织器官缺血再灌注模型中得到证实。Borghi[5]等观察16例临床原位肝移植术后细胞凋亡情况,发现IR后肝细胞发生一系列代谢、结构和功能的改变, 导致转氨酶升高,酶泄漏的发生,线粒体功能受损,活性氧化剂的增多,由此认为肝细胞的凋亡与肝IR损伤有关。本实验血生化结果证实了这种变化,并观察到OLT组随着再灌注时间的延长, 转氨酶(ALT、AST) 呈进行性升高。6h血清ALT、AST迅速升至最高,提示细胞严重受损,酶泄露严重;24h ALT、AST升高幅度开始回落,细胞修复能力加强;组织病检查有明显变化,并随灌注时间延长而加重。说明肝缺血再灌注损伤引发的细胞凋亡为一种动态过程,其原因可能是在不同阶段参与损伤的因素不同,是由多种因素综合作用的结果所致。Schlossberg[6]等观察小鼠肝IR损伤后细胞凋亡和组织修复的相关指标时发现细胞凋亡在肝叶IR后6h达峰值,且持续升高到20h以上,并在IR损伤急性期(1~3h)和亚急性期(6~20h)由不同的受体途径介导。在实验中,OLT组中CyclinD1、CyclinE的表达达最低值。
IP减轻肝IR损伤后肝细胞凋亡和增强细胞再生能力,目前已广泛证实,但其机制十分复杂;它与腺苷、一氧化氮、热休克蛋白、蛋白激C酪氨酸激酶依赖性信号系统、K+ ATP通道的激活等诸多因素有关[7]。本实验发现IP可通过上调(肝细胞抗凋亡基因bcl-2)活性来下调Fas凋亡途径中Fas-mRNA的表达和抑制caspase-3的活性[8],使细胞内容物(如DNA)避免氧化损伤,促使细胞周期中G1/S的转化启动,从而完成细胞再生[9]。Kuo[10]观察临床肝移植术后细胞凋亡情况时发现肝细胞凋亡与IR造成的生化损伤及病理学损伤参数改变呈正相关。实验中IP组肝移植前给予10min缺血,10min再灌注2次,血清转氨酶幅度较OLT组明显降低(P<0.01),病理变化显示肝细胞轻度水肿,小叶结构完整,超微结构变化示细胞膜结构完整,酶泄露少。再灌注后24h作为细胞周期正性调节蛋白CyclinD1与CyclinE在IP组24h的阳性表达率显著高于OLT组,提示移植肝细胞凋亡机制受限,肝细胞增殖机制活动增强。
增殖性细胞周期分为DNA及蛋白质合成准备期G1期、DNA合成期S期、有丝分裂准备期G2期、有丝分裂期M期。凋亡细胞的细胞周期常阻滞于G1/S期和(或)G2/M期,尤其G1末期限制性调控点“R”点的阻滞[11]。IP能够增加bcl-2活性,并于IR损伤后6h达高峰[8],bcl-2能够保护细胞避免各种形式释放NO诱导的凋亡,下调P53基因,干扰caspase-3活性(caspase-3是细胞凋亡效应分子,是Fas凋亡途径下游操作底物酶解的关键酶,被称为“凋亡执行者”);增加细胞周期基因及生长因子的调控能力[12]。作为细胞周期正性调节蛋白CyclinD1是肝细胞进入细胞周期G1期的显著标志,并随着细胞生长因子的增减而增减。CyclinD1能与CDK4和(或)CDK6(细胞周期依赖性激酶,与调节因子合称细胞周期引擎)特异性结合,形成CyclinD1-CDK4/CDK6复合物在G1中期激活,可使细胞周期中“R”限制点附近的抑制蛋白(如P503、Pb)磷酸化而失活,并释放转录因子E2F致使G1期缩短,同时加速G1/S的转换[13]。E2F又协同DP1启动G1/S转换相关基因的表达(如:CDK基因、CyclinE),在G1后期CyclinE与CDK2结合并激活CDK2形成CyclinE-CDK2复合物,使细胞通过“R”限制点,进入S期;同时减少细胞对生长因子的需要量,推进DNA复制和细胞的2倍增殖。由于细胞周期领带CyclinE的表达受转录因子E2F介导,而后者通过PRb被 CyclinD1依赖性激酶超磷酸化而激活,故CyclinE的表达依赖于CyclinD1依赖性激酶的活性,同时还受myc、Ras等基因调控。在本实验中笔者发现CyclinE的表达程度低于CyclinD1的表达,但表达时限基本相同[14]。据Meujoe[14]等报道,BACA/C大鼠肝IR损伤后12h CyclinD1RNA表达开始升高,在24~48h达最高峰,但术后2h比较差异无显著性,可能与细胞周期启动因子INF-α、IL-6、EHGF等调控在IR损伤术后4~6h才开始启动有关[15]。
IR 损伤和IR后的肝细胞增殖涉及到许多复杂的机制,从以上实验结果来看:IP作为移植肝IR损伤的内源性保护机制,增强bcl-2活性,抑制caspase-3及Fas-mRNA的表达,提高正性调节蛋白CyclinD1、CyclinE的调控能力,抑制细胞凋亡,促进再灌注早期肝细胞再生能力增强,从而使移植肝在灌注后肝脏功能迅速启动,为临床上预防肝移植术后原发性移植肝无功能及功能不良提供了新的理论依据。但IP如何使细胞增殖顺利通过G2/M期的机制尚需进一步研究阐明。
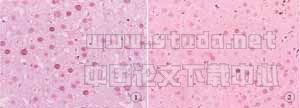
图1 OLT组CyclinDl的表达 (×200)
图2 OLT组24h CyclinE的表达 (×200: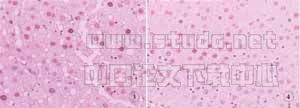
图3 1P组24h CyclinDl的表达 (×200)
图4 1P组24h CyclinE的表达 (×200)
【】
1 Kume M, Yamamoto Y, Saad S, et al. Ischemic preconditioning of the liver in rat:implications of heat shock protein induction to increase tolerance of ischemia-reperfusion injury.J Iab Clin Med,1996,128(3):251-258.
2 Glavien PA, Yadav A, Sindram D, et al. Protection effects of ischemia precondition for liver resection performed under inflow ocdusion in humans. Ann Surg,2000,235:155-162.
3 Snover DC, Freese DK, Sharp HL, et al. Liver allograft rejection.Am J Surg,1989,21(1):2397.
4 孙君泓,吴孟超,曾琪华.300次大鼠原位肝移植.中华器官移植杂志,1990,11(1):19.
5 Borghi SG. Apoptosis after ischemia-reperfusion in human liver allografts. Liver Transpl Surg,1997,3:407-415.
6 Schlossberg H, Zhang Y, Dudus, et al. Expression of c-fos and c-jun during hepatocellular remodeling following ischemia-reperfusion in mouse liver. Hepatology,1996,8:1546-1555.
7 Peralta C, Hotter G, Glosa D, et al. Hepatic preconditioning in rat is defined by balance of adenosine and xanthine. Heaptology,1998,28(3):768-773.
8 Lazennec JY, Pouzet B, Rammare S, et al. Anatomic basis of minimal anterior extraperitoneal approach to the lumbar spine. Surg Radiol Anat,1999,21(1):7-15.
9 Kadaw SS, Sindram D, Pretty DK, et al. Ischemic preconditioning protect the mouse liver inhibition of apoptosisthroughcaspase dependent path way. Hepatology,1999, 30(5):1223.
10 Kuo Pc, Drachenberg CI, De la Torre A,et al. Apoptosis and hepatic allograft reperfusion injury. Chin Transplant,1998,12(3):219.
11 Hunter T, Pines J. Cyclins and cancer I:cyclin D.and CDK inhibitors come of age. Cell,1994,79:573-582.
12 Yang J, Lin XS, Bhalla K, et al. Prevention of apoptosis by bcl-2 release of cytochrome C from mitochondria blocked. Science,1997,275:1129-1132.
13 江国春,袁莉珍,魏康.细胞周期蛋白D.国外医学·遗传学分册,1998,21(4):173.
14 安康.细胞周期调控网在肝部分切除后肝再生中的作用.国外医学·外分册,2001,28(3):151-153.
15 Su AI, Guilotti L G, Pezacki JP, et al. Gene expression during the priming phase of liver regenevation after partial hepatectomy in mice. Pro Natl Acad Sci USA。











