1α,25(OH)2D3对Th2细胞分化的影响
作者:李晓青,周小建,洪庆,洪建国
【摘要】 目的 探讨不同条件下生理浓度的1α,25(OH)2D3对Th2细胞分化的影响。方法 取9名健康产妇的脐血单个核细胞(CBMC)(106/ml),分别设PD组[PHA+1α,25(OH)2D3(10-8M)]和PDI组[PHA+IL-4(450u/ml)+1α,25(OH)2D3(10-8M)]进行培养。流式细胞术检测CD4+IL-4+细胞比例,SPSS11.5分析检测结果。结果 PD组CD4+IL-4+细胞分别为(2.11±1.37)%(d1),(1.73±0.79)%(d3),(0.46±0.19)%(d7);PDI组为(1.04±0.69)%(d1),(1.30±0.61)%(d3),(0.37±0.15)%(d7)。PD和PDI各自组内差异有显著性(F=7.932和7.162,P<0.01),两两比较显示d7较d1差异均有非常显著性(P<0.01)。三个时间点的组间比较,PDI组比例低于PD组,差异有显著性(P<0.05)。结论 本研究发现,生理浓度的1α,25(OH)2D3作用于单一环境或模拟Th2优势环境下的脐血单个核细胞7天时,都对Th2细胞分化产生抑制效应,后者作用更显著。
【关键词】 1α,25(OH)2D3;单个核细胞;Th2;IL-4
【Abstract】 Objective To analyze the effect of 1α,25(OH)2D3 in physical concentration on Th2 cell differentiation under different conditions. Methods The nine cases of CBMC(106/ml)were divided into two groups containing alternative culture medium, including of PHA+1α,25(OH)2D3(10-8M) and PHA+1α,25(OH)2D3+IL-4. The differentiation of cord blood CD4+T cell were investigated at three endpoints, using a flow cytometry-based intracellular cytokine detection method. One-Way Anova was used to compare the mean values among subgroups. LSD (Least Significant Difference) was used to compare the mean values of every two subgroups.Results The means values of CD4+IL-4+ cell in group PD were (2.11±1.37)%(d1), (1.73±0.79)%(d3),( 0.46±0.19)%(d7); and the ones in group PDI were (1.04±0.69)%(d1),( 1.30±0.61)%(d3),(0.37±0.15)%(d7), respectively. The difference of the mean values among subgroups was significant(F=7.932 and 7.162, P<0.01), with all the mean values on d7 decreasing significantly from d1 (P<0.01). The comparison between groups at three endpoints suggested that the mean values of CD4+IL-4+ in PDI group were less than those in PD group (P<0.05).Conclusion 1α,25(OH)2D3 in physical concentration inhibits Th2 polarization alone, as well as coexisting with IL-4. The effect of the latter is more significantly.
【Key words】 1α,25(OH)2D3;CBMC;Th2;IL-4
1α,25(OH)2D3是一种激素,除调节钙磷平衡外,还对细胞分化、增殖具有重要的调节作用。体外实验研究发现,1α,25(OH)2D3可能通过促进TGF-β和IL-4的合成来抑制Th1反应,提示1α,25(OH)2D3在免疫系统中具有一定的抑制Th1分化的功能;但也有资料显示1α,25(OH)2D3在T细胞分化中不仅限于对Th1细胞因子生成的抑制作用。本研究通过观察生理浓度的1α,25(OH)2D3对脐血Th2细胞分化的影响,探讨1α,25(OH)2D3对变态反应性疾病发病机制的影响。
1 材料与方法
1.1 材料 选取健康产妇的脐血标本9份,分离获取单个核细胞(CBMC)。
1.2 标本处理 用含肝素(200u/ml)的50ml无菌刻度离心管,由脐静脉采集脐血20~30ml,加入6%右旋糖酐中混匀,放入37℃水浴。取白细胞上清液,用淋巴细胞分离液处理后,分离获得CBMC,计数后悬浮于RPMI1640培养液中。
1.3 分组培养 采用96孔培养板,每孔加入等量细胞悬液(浓度:106/ml)和PHA刺激剂(10μg/ml)。分PD和PDI两组进行培养,PD组加入1α,25(OH)2D3(10-8M),PDI组加入IL-4(450u/ml)+1α,25(OH)2D3(10-8M)。1α,25(OH)2D3浓度与体内生理浓度相当,IL-4浓度则相当于正常细胞分化状态下的浓度。
1.4 CD4+IL-4+细胞比例检测 培养到第1、3天和第7天时,分别检测其中CD4+IL-4+细胞的比例。检测前作细胞计数,活细胞率≥80%则结果有意义。作应用流式细胞术检测前,以PMA、离子霉素、莫能霉素等对受检细胞进行处理。具体步骤包括激活、表面染色、穿透、固定等。应用PE-cy5标记的CD4单抗和8D4-8PE标记的IL-4抗体进行双色染色。相同的流式检测步骤重复3次,取均值。
1.5 统计学方法 采用SPSS11.5进行统计学分析,以α=0.05为显著性检验标准。
2 结果
2.1 入选产妇的一般情况 健康新生儿脐静脉血9份。所有产妇为第1次分娩,顺产,羊水清。男4例,女5例,均为足月儿,新生儿APGAR评分均≥8分,发育良好。产妇妊娠期间无明显维生素缺乏症状,亦无额外补充,未接受任何影响免疫功能的。
2.2 检测前的细胞计数 流式检测前的细胞计数,9例标本的细胞浓度均>106/ml,最低为1.25×106/ml,活细胞率均>90%,符合流式细胞术检测对细胞数量的要求,提示最终检测结果的意义。
2.3 流式细胞术检测CD4+IL-4+细胞浓度的结果 见表1。
表1 PD组和PDI组CD4+IL-4+细胞检测结果 (%)
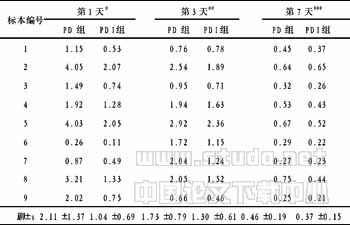
注:(1)组内比较PD组F=7.932,PDI组F=7.162,P <0.01;(2)组间比较#t=4.458,P<0.01;##t=4.938,P<0.01;###t=3.028,P<0.05
2.4 统计学分析结果 PD组和PDI组3个时间点各自组内比较,方差齐性(P>0.05),差异有显著性(F=7.932和7.162,P<0.01)。两两比较显示,第7天均较第1天呈下降样改变,差异有非常显著性(P=0.001和0.015),提示1α,25(OH)2D3作用7天,对Th2细胞分化具有较强的抑制作用。组间比较显示,PDI组CD4+IL-4+细胞浓度的下降较PD组更明显,差异有统计学意义(d1 t=4.458,P<0.01;d2 t=4.938,P<0.01;d3 t=3.028,P<0.05)。提示IL-4共存条件下,1α,25(OH)2D3的抑制效应更显著。
3 讨论
近年发现,1α,25(OH)2D3是一种作用广泛的内分泌/旁分泌激素,对细胞的分化增殖起到重要的调节作用[1]。20世纪70年代后期,随着组织细胞上维生素D受体(VDR)的发现,确定其不仅作用于以往所知的小肠、远端肾小管和成骨细胞,参与钙磷平衡调节,还有许多未知的作用部位,如皮肤角化细胞、卵巢细胞和T细胞等。1α,25(OH)2 D3是一种脂质分子,能和一些细胞因子和生长因子组成细胞局部生物学行为调节[2]。一些研究阐明,1α,25(OH)2D3能抑制Th1细胞分化所必需的细胞因子IL-12和Th1细胞的产生,证实其在Th1介导的自身免疫性疾病中的效应。许多报道在指出1α,25(OH)2D3对Th1细胞因子具有抑制作用的同时,提出了对维生素D可能诱发变态反应性疾病的担忧。
变态反应性疾病包括哮喘、变应性鼻炎和变应性皮炎,其致病核心是Th2细胞功能的上调[3~5],Th2细胞主要的细胞因子IL-4、IL-5和IL-13等能诱导原始细胞向Th2方向分化。本研究分组观察生理浓度的1α,25(OH)2D3在单一和并存IL-4的条件下,对CBMC Th2细胞分化的影响。结果显示,PD组的1α,25(OH)2D3干预对CD4+IL-4+起持续的抑制作用,第7天时仍表现为抑制样特征;PDI组的1α,25(OH)2D3对CD4+IL-4+的生成则经历了一过性促进作用,随作用时间的延续,此促进作用逐渐减弱,后转为抑制效应。提示不论是在单纯环境,还是在模拟Th2细胞优势的环境下,作用7天时,1α,25(OH)2D3均对Th2细胞分化具有一定的抑制作用。
国外学者做了一些流行病学调查,Hypponen和Sovio对1966年在芬兰2个主要省份出生并长期居住的所有个体进行调查,了解出生后第1年补充1α,25(OH)2D3与31岁前发生过敏症的相关性。结果提示,早期补充1α,25(OH)2D3与变应性皮炎和鼻炎发病呈正相关,与哮喘发病无关联[6]。可见1α,25(OH)2D3对各种过敏症发病的作用也可能存在差异。
一项鼠实验中,在OVA刺激后第1天起给予注射1α,25(OH)2D3,设安慰剂对照组,然后对1α,25(OH)2D3的效应进行分析[7]。结果发现,1α,25(OH)2D3显著抑制了支气管灌洗液中抗原诱导的嗜酸粒细胞募集并减少了淋巴细胞移行。同时,组支气管灌洗液的IL-4水平较对照组显著降低。也有些研究发现,用1α,25(OH)2D3处理后的鼠模型,IL-4和IL-13水平显著增高而IL-5与IFN-γ显著降低,提示1α,25(OH)2D3对不同的特异性Th2细胞因子也可能产生不同的效应。
有学者认为,1α,25(OH)2D3对细胞因子产生效应主要是在细胞分化的早期[8],因而推测在具有CD4+T细胞Th2细胞分化优势的炎症反应中,可能不产生效应。有研究用鼠模型在CD4+T细胞分化产生Th2效应细胞后的不同阶段,针对BALF的抗原诱导性嗜酸细胞和淋巴细胞,研究1α,25(OH)2D3的效应。结果发现1α,25(OH)2D3对哮喘性炎症反应始终有显著抑制作用,并且显著降低了鼠支气管和血管周围的炎症渗出,治疗组比未治疗组炎症分数也有所降低[9]。由此推断,在已有Th2细胞分化的情况下,1α,25(OH)2D3仍对其有下调作用,但后期干预的抗炎效应与早期干预组相比,前者的抑制作用逊于后者。
本实验结果提示,在Th2细胞优势情况下,1α,25(OH)2D3作用7天时,对Th2细胞分化呈抑制表现,提示1α,25(OH)2D3 在作用后的初期阶段并未对Th2细胞分化产生促进作用,相反具有抑制效应。笔者认为生理浓度的1α,25(OH)2D3没有促进CBMC表现为Th2细胞优势分化的趋势,因而不存在诱发变态反应性疾病的危险,提示在生后初期生理浓度的1α,25(OH)2D3具有抑制Th2分化的作用,对过敏症高危人群的发病可能还有一定的预防作用,其远期的影响有待进一步研究和探讨。
【】
1 Lemire JM. Immunomodulatory actions of 1,25-dihydroxyvitamin D3. J Steroid Biochem Mol Biol, 1995, 53(1~6): 599-602.
2 Holick MF. McCollum Award Lecture, 1994, Vitamin D-new horizons for the 21st century. Am J Clin Nutr, 1994, 60(4): 619-630.
3 Webb D, McKenzie A, Koskinen A, et al. Integrated signals between IL-13, IL-4, and IL-5 regulate airways hyperreactivity. J Immunol, 2000, 165(1): 108-113.
4 Chiappelli F, Manfrini E, Franceschi C, et al. Steroid regulation of cytokine. Relevance for TH1-to-TH2 shift, Ann N Y Acad Sci, 1994, 746(1): 204-215.
5 Jenmalm MC, Bjorksten B, Macaubas C, et al. Allergen-induced cytokine secretion in relation to atopic symptoms and immunoglobulin E and immunoglobulin G subclass antibody responses. Pediatr Allergy Immunol, 1999, 10(3): 168-177.
6 Hypponen E, Sovio U, Wjst M, et al. Infant vitamin D supplementation and allergic conditions in adulthood: northern Finland birth cohort 1996. Ann N Y Acad Sci, 2004, 1037(1): 84-95.
7 Topilski I, Flaishon L, Naveh Y, et al. The anti-inflammatory effects of 1,25-dihydroxyvitamin D3 on Th2 cells in vivo are due in part to the control of integrin-mediated T lympocyte homing. Eur J Immunol, 2004, 34(4):1068-1076.
8 Mahon BD, Wittke A, Weaver V, et al. The targets of vitamin D depend on the differentiation and activation status of CD4 positive T cells. J Cell Biochem. 2003,89(5): 922-932.
9 Ray A,Cohn L. Th2 cells and GATA-3 in asthma: new insights into the regulation of airway inflammation. J Clin Invest. 1999,104(8): 985-993.











