无血清两步法脐血巨核祖细胞体外扩增及诱导成熟的研究*
作者:莫文健,毛 平,李庆山,何秋山,应 逸,朱志刚,许艳丽
【摘要】 目的 建立一种新的脐血无血清培养两步法,通过脐血单个核细胞体外培养获得大量的巨核细胞,为临床研究提供平台。方法 首先将脐血单个核细胞在无血清培养液中加入TPO、SCF、IL-6、IL-3培养至14天行巨核祖细胞体外扩增,然后单纯加入TPO、IL-6再培养4天诱导巨核细胞成熟,在0、6、10、14、18天分别进行单个核细胞(MNC)数、CFU-MK、CD41+细胞的检测,第18天进行形态学检测。结果 CFU-MK于培养第10天最高,扩增了6.8倍。MNC、CD41+细胞数于第18天最高,MNC数扩增了4.8倍,CD41+细胞扩增了44倍。在第18天,有核细胞形态学分析50%~74%为巨核细胞,巨核细胞中94%~96%为颗粒及产板型巨核细胞。结论 在体外,使用这种新的两步培养法可获取大量的脐血来源的巨核细胞以供研究使用。
【关键词】 脐血;单个核细胞;无血清培养;巨核细胞;成熟
【Abstract】 Objective Development a new two-step method to get many CB-derived megakaryocytes from cord blood mononuclear cells (MNCs) for clinical research.Methods First, cord blood MNC were cultured in serum-free medium by a two-step approach using TPO, IL-3, SCF and IL-6 for 14 days followed by TPO and IL-6 only for another 4 days. The numbers of MNCs, CFU-MKs and CD41+cells were measured at day 0,6,10,14 and 18. Morphology analysis were taken at day 18.Results The time point of maximal CFU-MK,MNC,CD41+cells number is at day 10,18 and 18. The number of CFU-MK, MNC,CD41+ cells expanded 6.8,4.8 and 44 fold respectively. At day 18, 50%~74% mature megakaryocytes can be identified by morphology in the nucleated cells. 94%~96% of the megakaryocytes are granular megakaryocytes and thrombocytogenous megakaryocytes. Conclusion In vitro, we can harvest a lot of megakaryoctes derived from cord blood in the new two-step method.
【Key words】 umbilical cord blood; mononuclear cell; serum-free culture; megakaryocyte; mature
脐血造血干细胞移植后血小板恢复时间延迟是困扰临床的一大难题,大量研究表明,这主要与脐血中巨核祖细胞数量不足及脐血巨核细胞分化成熟障碍有关[1]。其中,脐血巨核细胞为何会出现分化成熟障碍已成为目前研究的热点之一。而大量的脐血巨核细胞为进一步研究所必需,笔者为体外获取大量的脐血巨核细胞建立了一个新的较简便、有效的培养方法,为进一步研究提供了平台。在国内未见相关报道。现报道如下。
1 材料与方法
1.1 研究对象 以从足月正常分娩的健康产妇脐静脉采集的脐血MNC为研究对象,脐血由广州医学院附属广州市第一人民妇产科提供。
1.2 主要试剂 HES(含6%羟乙基淀粉的0.9%氯化钠注射液)购自美国B.Braun公司。淋巴细胞分离液购自医学院血液研究所。TPO、IL-3、SCF、IL-6均购自英国Pepro Tech公司。无血清培养液使用StemSpanTM SFEM,巨核系祖细胞集落(CFU-MK)培养及鉴定体系使用MegaCultTM-C试剂盒,均购自加拿大Stem Cell Technologies公司。
1.3 MNC的分离 采集足月妊娠的健康产妇脐血,以肝素抗凝(20u/ml),脐血采集量40~60ml,共采集6例,采集后2h内进行分离处理。以淋巴细胞分离液分离MNC后,以磷酸盐缓冲液(PBS)洗涤2次。按1×107/ml细胞浓度加入无血清培养液StemSpan,在5%CO2、37℃及饱和湿度条件下在6孔培养板中孵育2h,以去除粘附细胞及残余血小板。孵育后,取出去粘附后MNC,用PBS 100g洗涤1次后备用。
1.4 细胞的培养接种 将去粘附后MNC按1×106/ml接种于无血清培养液StemSpan中,在StemSpan中加入青霉素(100u/ml)、链霉素(100μg/ml)及细胞因子。按细胞因子组合的不同分组如下:阴性对照组、细胞因子组。细胞因子终浓度为:TPO 50ng/ml,IL-3 20ng/ml,SCF 50ng/ml,IL-6 20ng/ml。培养体系接种于50ml培养瓶中,每瓶液体总量为6ml,在5%CO2、37℃及饱和湿度条件下培养18天,第6、10天进行1/3量换液,加入新鲜培养液及相同浓度的细胞因子。在第14天进行1/3量换液,仅加入相同浓度的TPO、IL-6延长培养至第18天。
1.5 MNC、CD41+细胞、CFU-MK的检测 在培养的0、6、10、14、18天取出细胞行MNC数、流式CD41+细胞比例及CFU-MK的检测。MNC为人工计数,CD41+细胞比例由流式细胞仪检测,而CFU-MK用MegaCultTM-C试剂盒进行检测。
1.6 培养后脐血巨核细胞的形态学分析 延长培养至18天时,将培养后细胞离心涂片、风干,加入瑞氏染液染色,然后,在显微镜下观察培养后有核细胞中脐血成熟巨核细胞的比例、形态学特点及产板情况。
1.7 统计学分析 实验数据以x±s表示,所有数据均采用SPSS软件分析,统计方法为ANOVA,P<0.05为差异有显著性,P<0.01为差异有非常显著性。
2 结果
见表1。
表1 细胞因子组对脐血MNC、CFU-MK、CD41+细胞的扩增作用 (x±s,n=6)
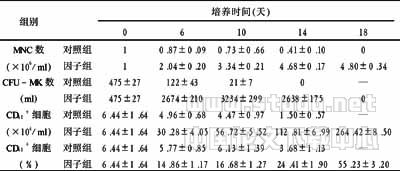
在6、10、14天,因子组的MNC总数、CFU-MK数、CD41+细胞总数、CD41+细胞百分比均优于对照组(P<0.01)。而至18天,对照组已未见细胞,故未做统计学对比。
由表1可见,脐血MNC在无血清培养液stemspan中加入TPO、SCF、IL-3、IL-6 4种细胞因子培养至10天,CFU-MK数量达到最多,达培养前的6.8倍,而CD41+细胞占MNC细胞的约17%,CD41+细胞扩增了8.8倍。在第14天,CFU-MK为培养前5.6倍,CD41+细胞占MNC细胞的约24%,CD41+细胞扩增了17.5倍。通过分阶段培养,在第14天起单纯给予TPO及IL-6促进脐血巨核祖细胞分化,巨核细胞分化成熟。第18天,CFU-MK基本已检测不出,CD41+细胞占MNC细胞比例升至55%左右,而CD41+细胞数扩增达44倍左右。
在因子组培养至第18天,取细胞离心涂片进行形态学分析,可见大量的形态学可辨认的成熟巨核细胞,占总有核细胞数(NC)数的59%±9%(50%~74%),其中96%±2%(94%~96%)为颗粒型及产板型巨核细胞,27%±5%(21%~35%)为产板型巨核细胞,但培养所得巨核细胞均呈单个核,绝大多数巨核细胞呈特征性的“核浆发育不平衡,胞核发育延迟”。以产板巨核细胞尤为明显,其胞浆虽已产板,但核仍幼稚,可见核仁(见图1、2、3、4)。
3 讨论
3.1 关于培养条件、细胞因子组合及培养策略的选择 脐血体外扩增的起始细胞应采用MNC还是CD34+细胞,目前仍有争议[2]。但从短期培养及简便的角度来说,MNC作为培养起始细胞具备一定的优势。而在无血清培养液中,由于去除了血清中巨核系增殖的抑制物成分,更有利于巨核系的体外扩增[3]。因而在本实验中,笔者选择以脐血MNC作为培养的起始细胞,商业用无血清培养液stemspan作为培养的基质。而在细胞因子中,TPO在体外不仅能促进巨核系祖细胞的体外扩增,而且还能促进巨核细胞的成熟,是巨核系体外扩增及诱导成熟的关键性因子。在体外常用的协同作用因子中,主要协同促进巨核系祖细胞扩增的早期作用因子包括:IL-3、SCF、FL等,而主要协同促进造血干细胞向巨核系分化及诱导成熟的晚期作用因子包括:IL-6、IL-11等[1]。在本实验中,笔者采用TPO+SCF+IL-3+IL-6为巨核祖细胞体外培养的因子组合,发现其CFU-MK数于第10天最多,因而,我们在早期选用该组合进行巨核祖细胞体外扩增,之后再在第14天使用TPO、IL-6促进巨核细胞祖细胞分化及巨核细胞成熟,取得较好的效果,获得了大量脐血源的巨核细胞。
3.2 关于脐血巨核细胞体外成熟障碍的研究 在脐血巨核系体外扩增的过程中,多个研究发现使用TPO等细胞因子培养后,脐血虽能产生明显较骨髓及外周血多的巨核细胞,但这些巨核细胞大多呈不成熟状态[4~6]。Miyazaki等[6]对经TPO+SCF+IL-3培养7天后的脐血源及骨髓源巨核细胞比较发现,脐血源的巨核细胞大多呈2倍体(2N、单个核),而骨髓源的巨核细胞中核倍体>2N的细胞易见,其8N、16N、32N的巨核细胞明显多于脐血。形态学观察,骨髓源的巨核细胞较大,胞浆内可见颗粒,易见幼稚血小板形成,而脐血源巨核细胞则较小,胞浆较幼稚且未见血小板形成,结合脐血巨核细胞CD41荧光强度明显弱于骨髓,提示脐血源巨核细胞较幼稚,成熟及产血小板能力较差,因而,不少学者推断,脐血移植后延迟的血小板恢复除与移植物中巨核系祖细胞数量不足有关外,还可能与脐血巨核细胞成熟障碍有关[4~6],关于脐血巨核细胞为何会出现这种成熟障碍以及能否诱导其完全成熟,是目前研究的一个热点。
因而如何获取大量的脐血巨核细胞,是进一步研究的重要前提。为获取足够的巨核细胞以进行研究,Majka等[7]采用分阶段的方法,将脐血CD34+细胞在无血清条件下,先用TPO+IL-3扩增11天,然后用TPO培养7天,从而产生较大量的脐血源巨核细胞以供进一步研究使用。而Sun等[8]亦采用了类似的分阶段培养法,将脐血CD34+细胞先用TPO+IL-3+SCF培养7天,再用TPO培养14天,从而得到超过70%的脐血源巨核细胞。本实验中,我们尝试用脐血MNC经TPO+IL-3+SCF+IL-6培养至14天后,单纯给予相同浓度的TPO、IL-6诱导巨核祖细胞分化及巨核细胞胞核及胞浆的分化成熟,结果在培养第18天发现培养液中出现大量的形态学可辨认的成熟巨核细胞(占50%~74%)。但因为以脐血MNC作为培养的起始细胞,因而较使用CD34+为培养起始细胞更为简便,成本也较低。
在我们的实验中,经离心涂片、瑞氏染色及分类发现,这些脐血体外培养所得的巨核细胞大多数为颗粒型及产板型巨核细胞,如报道[6],大部分的这些细胞均表现为胞核发育延迟,多叶核少见,但有趣的是,超过95%的巨核细胞胞浆发育是比较成熟的,可见有明显的颗粒形成,其中21%~35%的巨核细胞有产板现象,但表现为一种明显的“核浆发育不平衡、胞核发育滞后”。一般认为,巨核细胞的胞核倍体与胞浆颗粒形成及产板情况成正比,但在本实验中,培养后脐血源的巨核细胞形态特点却与此明显不相符。关于脐血巨核细胞这种独特的核发育延迟现象,Mattia等[9]通过比较脐血及外周血造血干细胞体外培养过程中巨核细胞的细胞周期素B1及D3的不同表达,推断脐血巨核细胞发育延迟可能与其核内有丝分裂障碍有关,但具体机制有待进一步阐明。在此,本实验已通过脐血MNC分阶段培养摸索出一种较简便易行的获取大量脐血巨核细胞的方法,为进一步的深入研究提供了平台。
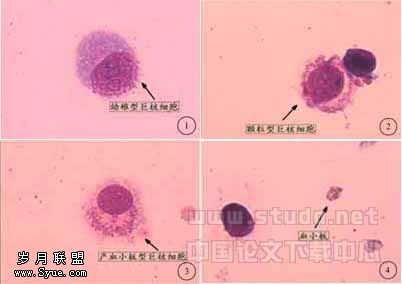
图1 培养后的幼稚型巨核细胞(10×100)
图2 培养后的颗粒型巨核细胞(10×100)
图3 培养后的产板型巨核细胞(10×100)
图4 培养后产生的血小板(10×100)
【文献】
1 莫文健,毛平.巨核系前体细胞体外扩增研究进展.国外医学·输血及血液学分册,2002,25(6):539-542.
2 Dao MA,Nolta JA.CD34:To select or not to select ? That is a question. Leukemia,2000,14 (5): 773-776.
3 Van den Oudenrijn S, Van dem Borne AEGK, De Haas M. Influence of medium components on ex vivo megakaryocyte expansion. J Hematother Stem Cell Res,2001,10(1):193-200.
4 Van den Oudenrijn S,Von dem Borne AEGK,De Haas M. Differences in megakaryocyte expansion potential between CD34+ stem cells derived from cord blood,peripheral blood,and bone marrow from adults and children.Exp Hematol,2000,28 (9): 1054-1061.
5 Schipper LF, Brand A, Reniers N,et al. Differential maturation of megakaryocyte progenitor cells from cord blood and mobilized peripheral blood. Exp Hematol,2003,31(4):324-330.
6 Miyazaki R, Ogata H, Iguchi T,et al. Comparative analyses of megakaryocytes derived from cord blood and bone marrow. Br J Haematol,2000,108(3):602-609.
7 Majka M, Baj-Krzyworzeka M, Kijowski J, et al.In vitro expansion of human megakaryocytes as a tool for studying megakaryocytic development and function.Platelets,2001,12 (6):325-332.
8 Sun L, Tan P, Yap C,et al. In vitro biological characteristics of human cord blood-derived megakaryocytes. Ann Acad Med Singapore,2004,33(5):570-575.
9 Mattia G, Vulcano F, Milazzo L, et al.Different ploidy levels of megakaryocytes generated from peripheral or cord blood CD34+ cells are correlated with different levels of platelet release. Blood,2002,99(3):888-897.











