脱细胞真皮基质(ADM)制备前后的变化
作者:霍孟华 戚可名 黄金井 庄强 管正玉 王阳 王法刚
【摘要】 目的 探讨脱细胞真皮基质制备前后出现的各种变化。方法 将人全厚皮切制成厚0.5mm的中厚皮片,先后经1M NaCl溶液、0.1%戊二醛、0.5%SDS、0.25%胰蛋白酶、冷冻干燥及水化处理,制得脱细胞真皮基质(ADM)。观察制备前后出现的各种变化。结果 皮片经处理后,ADM具有良好的弹性和柔韧性。皮片中所有细胞成分消失,胶原及弹力纤维结构完整、排列规则,基底膜存在。处理前后弹力/胶原纤维面密度分别为0.25±0.08和0.26±0.08、胶原含量分别为69.18±12.51和85.17±28.93、Ⅲ/Ⅰ型胶原比值分别为0.85±0.22和0.71±0.14,均无明显变化。结论 脱细胞真皮基质制备过程可有效去除皮肤中的细胞成分,完整保留真皮基质和基底膜,形成相对无免疫活性的脱细胞真皮基质。
【关键词】 脱细胞真皮基质 制备
Studies on the changes during preparation of acellular dermal matrix (ADM)
【Abstract】 Objective To investigate the changes during preparation of ADM.Methods Split-thickness allograft, 0.5mm thick, were obtained from full thickness human’s skins with a dermatome. Donor skins were treated with 1 M NaCL, 0.1% glutaraldehyde, 0.5 % SDS and 0.25 % trypsin successively. The resulting acellular dermal matrices were then freeze-dried in a freeze-dryer and hydrated in PBS. The processing technique resulted in acellular dermal matrices (ADM). The dynamic changes during processing were researched.Results All the cellular components in the donor skins were removed and basement membrane was retained. Regular orientation and integral framework of collagen bundles and elastin was present in elastic and flexible ADM. The area-density of elastin/ collagen, gross and Ⅲ/Ⅰ type ratio of collagen were 0.25±0.08, 69.18±12.51, 0.85±0.22 in the donor skins and 0.26±0.08, 85.17±28.93, 0.71±0.14 in the ADM respectively. There was no change after donor skins were treated.Conclusion The processing technique removed all the cellular components from the donor skins, retained dermal matrix and basement membrane, and acquired acellular dermal matrix that exhibited no immunocompetence.
【Key words】 acellular dermal matrix preparation
脱细胞真皮基质 (acellular dermal matrix, ADM) 是一种良好的基质,可作为真皮替代品与自体表皮复合移植,亦可作为软组织填充材料单独使用,临床上应用愈来愈广泛。最早由Liversey研制成功,并申请了美国专利[1];国内报道的制备方法差别较大,对此我们进行了研究,移植后亦获得了成功。现就其制备过程中出现的各种变化报道如下。
1 材料与方法
1.1 异体皮肤来源 异体皮肤来源于我院整形手术患者,术前查体正常,免疫学检查HBsAg、HCV、HIV、TP-Anti均为阴性。切下的健康皮肤制成厚约0.5mm的中厚皮片。
1.2 实验条件 整个实验过程均需在严格无菌条件下进行。
1.3 实验步骤 中厚皮片入1M NaCl溶液,37℃,浸泡24h→0.1%戍二醛缓冲液,37℃,浸泡5min→0.5%SDS溶液,37℃,浸泡2h→0.25%胰蛋白酶溶液,消化20min→大量的PBS溶液反复多次漂洗,至漂洗液无泡沫为止→冷冻干燥机,-60℃,ATM 56,持续12h→密封保存。
1.4 ADM的水化 室温下冷冻干燥的ADM置于PBS溶液中浸泡30min以上,即可使用。
2 结果
2.1 大体观察 皮片经高渗盐水处理后,表皮易于从真皮上呈片状完整剥离,有时在表皮和真皮之间形成水泡样间隙,毛发与表皮亦一起脱落。真皮呈瓷白色,富有弹性,形成基底膜和真皮两个面,其中基底膜面有光泽,比真皮面光滑(图1~4)。
戍二醛缓冲液、SDS、胰蛋白酶处理前后,外观无显著变化。
冷冻干燥处理后真皮变干、变硬,弹性明显减退,状如瓷白色皮革样。
水化处理后,与处理前的皮片相比,手感较酥软,弹性略有减退,厚度稍有增加。
2.2 细菌学检查 将ADM粉碎后进行细菌培养,未见细菌生长。

图1 人体正常皮肤,处理前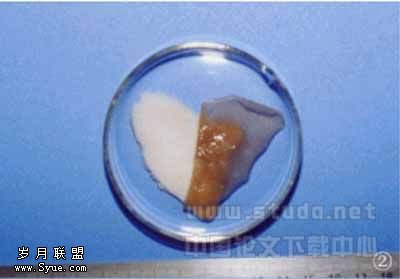
图2 1M NaCl处理后,表皮被掀起
图3 1M NaCl处理后,去除的表皮
图4 1M NaCl处理后的皮肤
2.3 组织学观察 HE染色显示皮片经高渗盐水处理后,表皮细胞各层均被完全去除,基底膜完整,形成一个连续的光滑面,真皮中的细胞成分仍然存在;经戍二醛缓冲液、SDS、胰蛋白酶处理后,真皮中所有的细胞成分即被完全去除,完整地保留了基质成分,即脱细胞真皮基质(图5~7)。
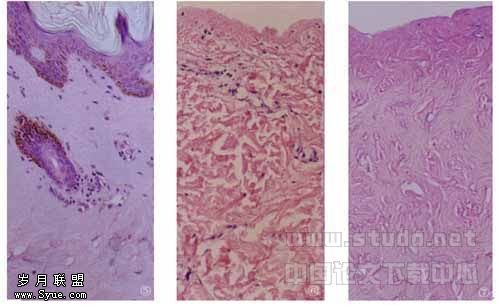
图5 图6 图7
图5 人体正常皮肤,HE×100
图6 1M NaCL处理后,无表皮细胞,基底膜完整,真皮中细胞残留,HE×100
图7 脱细胞真皮基质,无细胞存在,基底膜完整,HE×100
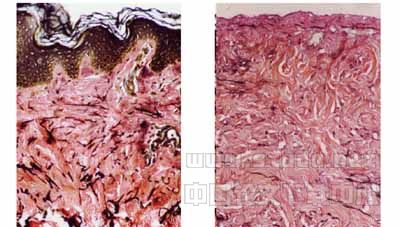
图8 图9
图8 人体正常皮肤,真皮内丰富的弹力纤维,Verhoeff×100
图9 脱细胞真皮基质,丰富的弹力纤维,Verhoeff×100
Verhoeff铁苏木素染色证实ADM中的胶原、弹力纤维形态规则、结构清晰、无肿胀,无变性坏死,排列整齐,整个处理过程对其无显著影响(图8~9)。
2.4 Verhoeff铁苏木素染色机图像分析结果 相同厚度(5μm)的组织切片,经Verhoeff铁苏木素染色,显示红色的胶原纤维和黑色的弹力纤维,于普通显微镜下观察其形态,并行计算机图像扫描,每个标本随机取10个视野,以北航医学图像分析系统对其进行体视学图像分析,分别以胶原纤维和弹力纤维为目标,测定其目标面积, 根据统计场面积计算其面密度(目标面积/统计场面积)。取其平均值,进行统计学处理、分析(见表1)。
2.5 生化检查分析结果
2.5.1 胶原含量的定量测定 新鲜组织标本反复烘烤成干组织,经水解、氧化、显色后,在分光光度计上进行比色,测定羟脯氨酸光密度值,根据羟脯氨酸标准曲线,计算出胶原的含量,取其平均值,进行统计学处理、分析(见表1)。
2.5.2 胶原分型定量测定 应用乙酸纤维素薄膜电泳,分离Ⅰ、Ⅲ型胶原,在分光光度计上分别进行比色,测出各自的光密度值,计算出每个标本Ⅰ、Ⅲ型胶原的比值,取其平均值,进行统计学处理、分析(见表1)。
表1 处理前后弹力/胶原纤维面密度、胶原含量、Ⅲ/Ⅰ型胶原变化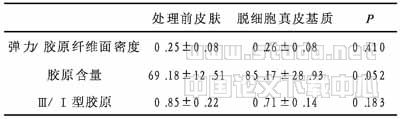
注:t 检验,处理前后差异均无显著性,P>0.05
3 讨论
众所周知,引起排斥反应的抗原物质存在于异体细胞的细胞膜上(即组织相容性抗原),对异体皮肤的排斥过程正是针对其表皮细胞和真皮中的成纤维细胞、血管内皮细胞等细胞成分[2,3],真皮的非细胞成分—细胞外基质蛋白和胶原(即ADM)—则相对无免疫活性,可永久地存在于宿主体内[4]。ADM的制备过程去除了异体皮肤中的细胞成分,使组织相容性抗原消失,成为一种良好的基质,可作为真皮替代品与自体表皮进行复合移植,亦可作为软组织填充材料单独使用。
高渗盐水处理皮肤,制成的ADM保留了基底膜复合物。经HE、Verhoeff染色已经证实了基底膜的存在,并形成一个连续的光滑面。对细胞提供结构上的支持,对培养的表皮细胞膜片及微粒皮移植,硬脑膜、横膈、血管及睑板缺损的修复具有重要的意义,有利于上皮细胞的粘附和增殖。
胶原纤维、弹力纤维结构的完整和排列规则是其发挥正常功能的结构基础和必需条件,肉芽组织和瘢痕组织正是以胶原束排列紊乱和弹力纤维缺乏为其特征的[5]。ADM可为宿主提供足够的、排列规整的基质成分,组织学检查证实ADM制备过程未对其纤维成分造成损伤,胶原纤维及弹力纤维形态规则、结构清晰、无肿胀,无变性坏死,排列整齐,从而最大程度地保留其基质的功能。
本研究表明:脱细胞真皮基质制备过程可有效地去除皮肤中的细胞成分,完整保留基底膜和真皮基质,形成相对无免疫活性的脱细胞真皮基质。
【】
1 Livesey SA. US Patent.#5,336,616.Lifecell Corporation,1994, 23-24.
2 Castagnolic C, Stella M, Magliacani G, et al. Anomalous express of HLA class II molecules on keratinocytes and fibroblasts in hypertrophic scars consequent to thermal therapy. Clin Exp Immunol,1990,82:350-354.
3 Sedmak DD, Orosz CG. The role of vascular endothelial cells in transplantation. Arch Pathol Lab Med,1991,115:260-265.
4 Yukan RA.Variable antigenicity of lyophilized allogeneic and lyophilized xenogeneic skin in guinea pigs. J Peridont Re,1997,12:197-201.
5 Kischer CW, Shetlar MR, Chvapil M, et al. Hypertrophic scars in keloids: a review and new concept concerning their orientation. Scan Electron Microsc,1982,4:1699-1713.











