口腔鳞状细胞癌中单核细胞趋化蛋白-1表达与肿瘤血管生成的关系
作者:宋宇峰 杨建斌 冯红超
【摘要】 目的 在其它肿瘤的研究中发现单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)参与了肿瘤的血管生成,本研究探讨口腔(鳞状细胞癌,简称鳞癌)中MCP-1表达与肿瘤血管生成的关系。方法 应用免疫组化方法检测41例口腔鳞癌和10例正常口腔黏膜MCP-1和CD34的表达,光镜下进行MCP-1表达的分级和微血管的计数。结果 口腔鳞癌中MCP-1的表达和微血管计数较正常口腔黏膜均增加(P<0.01),在鳞癌中随MCP-1表达的增加,微血管计数增加(P<0.01)。结论 MCP-1在口腔鳞癌中参与了肿瘤的血管生成,但其具体机制和在临床中的意义还需进一步的研究。
【关键词】 口腔鳞状细胞癌 肿瘤血管生成 单核细胞趋化蛋白-1
【Abstract】 Objective Many investigations have showed that monocyte chemoattractant protein-1(MCP-1)participated in tumor angiogenesis.To study the correlation between the expression of MCP-1 and angiogenesis by exploring the expression of MCP-1 and angiogenesis in oral squamous cell cancer(OSCC) and oral normal tissue.Methods The expression of MCP-1 and microvessel counts were detected by immunohistochemical methods in paraffin section of 41 OSCC and 10 normal oral tissues.Results The expression of MCP-1 in OSCC group was significantly higher than that in normal group(P<0.01):Microvessel counts in OSCC group was also higher than that in normal group(P<0.01).The expression of MCP-1 was significantly correlated with the microvessal counts(P<0.01).Conclusion MCP-1 plays a crucial role in angiogenesis of OSCC,but its mechanism and clinical significance need further investigation.
【Key words】 oral squamous cell cancer angiogenesis monocyte chemoattractant protein-1
肿瘤的形成是一个多因素参与并相互作用的复杂过程,新血管形成是肿瘤生长和转移的重要环节。肿瘤血管在细胞组成、组织结构及功能特点上同正常血管均有不同,其形成过程极其复杂,有许多因子在其中发挥着作用。在其它肿瘤的研究中发现单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)和肿瘤的血管生成有关,但在口腔癌中少见报道。本文通过免疫组化方法对41例口腔鳞状细胞癌(简称鳞癌)和10例正常口腔黏膜组织中MCP-1表达和微血管计数进行检测,探讨MCP-1在口腔鳞癌血管生成中的作用。
1 材料和方法
1.1 材料 搜集1998~2004年本院口腔颌面外科手术切除标本51例。口腔鳞癌41例,其中男29例,女12例,年龄34~76岁,平均56.27岁;舌癌15例,牙龈癌13例,口底癌8例,颊癌5例;高分化癌25例,中分化癌16例,无低分化癌。正常口腔黏膜组织10例,其中男5例,女5例;年龄10~58岁,平均32岁。肿瘤标本术前未经针对肿瘤的,标本均经病理证实。所有标本均经常规脱水、10%中性福尔马林固定、包埋、石蜡连续切片,切片厚度4cm。
1.2 免疫组织化学染色 鳞癌组和正常组均进行免疫组化常规SABC法染色。抗MCP-1抗体为兔抗人单克隆抗体(购自武汉博士德生物工程有限公司),工作浓度1∶100。抗CD34抗体为鼠抗人单克隆抗体(购自北京金桥中杉生物技术公司),克隆系QBEnd/10,用于特异性地标记微血管,工作浓度1∶80。所有标本均抗原热修复,DAB显色,苏木素复染后脱水、透明、封片。以上步骤均按说明书进行操作,严格控制时间及温度。每次染色均设阳性及阴性对照。用PBS代替一抗作为阴性对照。
1.3 结果评定 微血管计数参照Weidner[1]的方法:任何与邻近的微血管、肿瘤细胞及其它相连组织有明显分界的棕染内皮细胞或内皮细胞簇均视为一个血管计数,首先在低倍镜(40和100倍)下选取癌视野中微血管最密集的3个区域,然后在高倍镜(400倍)下进行血管计数,取平均值进行统计分析。MCP-1表达值的评定参照Hisashi Saji[2]的方法进行:首先在低倍镜(100倍)下选取阳性细胞最密集的5个区域,在高倍镜(400倍)下阳性细胞占总细胞数的百分比,其平均值视为MCP-1的表达值,分为0级:0~5%,1级:5%~50%,2级:>50%。
1.4 统计学方法 采用SPSS10.0软件包分别进行统计学分析。
2 结果
2.1 MCP-1及CD34在口腔鳞癌及正常组织中的表达 41例鳞癌样本中,MCP-1表达阳性者33例,MCP-1阳性表达主要分布于肿瘤细胞的胞浆,极少数细胞膜也有表达,呈棕色和棕褐色颗粒,细胞核无阳性表达,在间质细胞如巨噬细胞中也可见较多的表达(见图1);正常组织内阳性表达2例,主要在白细胞亚群和血管平滑肌细胞中表达。CD34阳性染色呈棕色和棕褐色颗粒,定位于血管内皮细胞胞膜和胞浆,血管呈条索状,或者血管内皮细胞呈簇状聚集,在癌组织内可见大量的微血管存在(见图2),对照组明显减少。
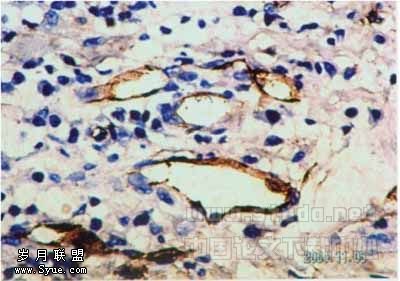
图1 口腔鳞癌中MCP-1的表达(SABC法,400×)
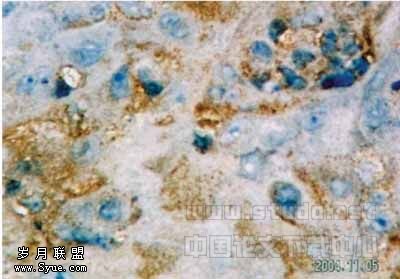
图2 口腔鳞癌中CD34的表达(SABC法,400×)
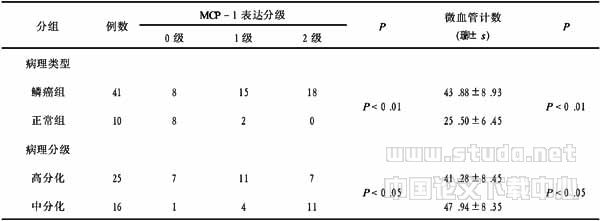
2.2 MCP-1表达及微血管计数与临床指标的关系 见表1。MCP-1表达在口腔鳞癌组和正常黏膜组之间存在差别,其差异有显著性(P<0.01);鳞癌组微血管计数高于正常组,差异有显著性(P<0.01)。口腔鳞癌中、高分化癌中MCP-1表达也有差别,差异有显著性(P<0.05);中、高分化癌微血管计数有差别,差异有显著性(P<0.05)。
表1 MCP-1表达及微血管计数与临床指标的关系
2.3 口腔鳞癌中MCP-1表达与微血管计数的关系 见表2。由表2可见口腔鳞癌中MCP-1的表达和微血管的计数有关,随MCP-1表达的增加,微血管计数增加,P<0.01.
表2 口腔鳞癌中MCP-1表达与微血管计数的关系
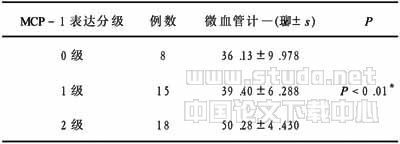
注:*两两比较:0级与1级差异无显著性(P>0.05);0级与2级差异有显著性(P<0.01);1级与2级差异有显著性(P<0.01)
3 讨论
实体肿瘤形成后,进入无血管的浸润前期,肿瘤细胞主要靠周围组织的弥散供给营养,此时肿瘤结节直径一般小于2~3mm。一旦肿瘤直径超过2~3mm,肿瘤组织内开始有新血管生长,肿瘤生长加速,且极易发生浸润和转移。所以,肿瘤血管生成和由此建立的肿瘤微循环是实体瘤持续生长和浸润转移的先决条件[3]。
笔者的研究结果表明:口腔鳞癌中,MCP-1的表达明显高于正常口腔黏膜组织;口腔鳞癌中微血管计数也明显高于正常口腔黏膜组织;MCP-1表达与微血管计数呈正相关。这就提示MCP-1与肿瘤血管生成有密切的相关性。MCP-1是化学介质CC家族的成员,拥有对单核细胞、树突细胞、NK细胞、T淋巴细胞的趋化性。MCP-1主要被肿瘤细胞分泌,也可被间质细胞分泌[2]。近期研究结果表明,在浸润的巨噬细胞中可以观察到MCP-1的丰富表达[4],这与笔者在口腔鳞癌中免疫组化的研究结果相符。
MCP-1参与多种病理、生理过程。就其对肿瘤的作用而言,它可以通过2个方面发挥肿瘤血管生成作用:(1)MCP-1可以直接促进血管生成。在许多炎性疾病中,如动脉粥样硬化和类风湿性关节炎,这些疾病的显著特点就是有较多的血管生成,而且MCP-1有着较高的表达[5,6];Rosalba Salcedo[7]等应用鼠主动脉环在没有炎性存在的情况下进行细胞培养,研究结果发现:MCP-1浓度在5~50ng之间可以刺激大量的毛细血管增生,显示了MCP-1在血管生成中的直接作用。(2)MCP-1通过使肿瘤内浸润的巨噬细胞,即所谓肿瘤相关巨噬细胞(Tumor-associated macrophages,TAMs)聚集、迁徙而发挥间接的血管生成作用。TAMs是肿瘤间质的一个主要成分,可能在口腔鳞癌的生长和转移中起着重要作用[8]。TAMs浸润进入肿瘤被许多细胞素和化学介质调节,MCP-1是主要的调节剂。本课题组先前的研究表明:口腔鳞癌中TAMs计数与微血管计数呈正相关,TAMs可以分泌细胞素如VEGF、VEGF-C[9,10],尤其是VEGF,已经证实在口腔鳞癌中是一个重要的促血管生长因子,而且与口腔鳞癌发生淋巴结转移有关[8]。这提示了MCP-1在血管生成中的间接作用。同时本研究中还显示口腔鳞癌中TAMs也可分泌MCP-1,这还说明TAMs还可能存在自分泌的情况,进一步促进巨噬细胞在口腔鳞癌中的浸润和聚集。总之,本研究显示口腔鳞癌组织中MCP-1有丰富的表达,而且与微血管计数密切相关,表明了MCP-1在促肿瘤血管生成中有一定的作用。但口腔鳞癌组织中MCP-1产生的机制仍需采用其它分析手段做进一步研究。
【】
1 Weidner N,Carroll PR,Flax J,et al. Tumour angiogenesis correlation with metastasis in invasive prostate carcinoma. Am J Pathol,1993,143(2): 401-409.
2 Hisashi Saji,Morio Kioke,et al. Significant correclation of monocyte chemoattractant protein-1 expression with neovascucarization and progression of breast carcinoma. Cancer,2001,92: 1085-1091.
3 Cavallaro U,Christofori G. Molecular mechanisms of tumor angiogenesis and rumor progression. J Neurooncol,2000,50(1-2): 63-70.
4 Takayuki Uneo,Masakazu Toi,et al. Significance of macrophage chemoattractant protein-1 in macrophage recruitment ,angiogenesis,and survival in human breast cancer. Clinical Cancer Research,2000,6: 3282-3289.
5 Cushing SD,Berliner JA,Valente AJ,et al. Minimally modified low density lipoprotein induces monocyte chemotactic protein-1 in human endothelial cells and smooth muscle cells. Proc Natl Acad Sci USA,1990,87:5134-5138.
6 Koch AE,Kunkel SL,Harlow LA,et al. Enhanced production of monocyte chemoattractant protein-1 in rheumatoid arthritis. J Clin Invest,1992,90:772-779.
7 Rosalbo Salcedo,Maria Lourdes Ponce,et al. Human endothelial cells express CCR2 and respond to MCP-1: direct role of MCP-1 in angiogenesis and tumor progression. Blood,2000,96(1): 34-40.
8 冯红超,宋宇峰.口腔鳞癌中肿瘤相关巨噬细胞(TAMs)和血管生成与淋巴结转移的关系.临床口腔医学杂志,2003,19(3):135-137.
9 冯红超,宋宇峰,温玉明.口腔鳞癌中VEGF表达和肿瘤相关巨噬细胞在血管生成作用中相互作用的初步研究.肿瘤临床,2004,31(8):435-438.
10 冯红超,宋宇峰,温玉明.口腔癌组织中血管内皮生长因子-C在肿瘤血管巨噬细胞内的表达及与淋巴结转移的关系.癌症,2004,23(3):278-281.











