罗格列酮改善高脂饲养大鼠胰岛素抵抗机制的研究
【关键词】 罗格列酮;胰岛素抵抗;脂肪细胞;凋亡;瘦素;PPAR-γ;肿瘤坏死因子
近年研究表明[1,2],罗格列酮等可明显改善高脂饮食诱导的胰岛素抵抗(IR)状态,但具体机制尚有待探讨。本研究通过对高脂饮食诱导胰岛素抵抗大鼠以罗格列酮灌胃观察脂肪组织分布、脂肪细胞因子表达及脂肪细胞凋亡的变化,以探讨罗格列酮改善胰岛素抵抗的机制。
1 材料与方法
1.1 高脂饮食大鼠胰岛素抵抗模型的建立 雄性SD大鼠24只,体重206~228g(大鼠由上海第二军医大学动物实验中心提供),随机分为正常对照组、高脂饮食对照组、高脂饮食罗格列酮治疗组,每只大鼠的热卡摄入为310kJ/d。正常组给予标准饲料(碳水化合物热卡占63%,脂肪热卡占12%,蛋白质热卡占25%),高脂组给予新鲜配制的高脂饲料(碳水化合物热卡占20%,脂肪热卡占61%,蛋白质热卡占19%)。高脂饲料中的脂肪成分主要是熟猪油。高脂饮食罗格列酮治疗组给予罗格列酮灌胃,剂量为3mg/kg,罗格列酮粉剂(99%)由史克必成有限公司提供,其余两组给予相当剂量的蒸馏水灌胃,实验周期为7周。
1.2 空腹血糖、胰岛素(Ins)的测定 大鼠禁食8~10h后,从后眼眶静脉丛取血,血糖用葡萄糖氧化酶法测定。胰岛素以放射免疫法检测。采用北京北方生物技术研究所生产的放免试剂盒及上海核福光电仪器有限公司生产的SN-682型放射免疫计数仪测定血清胰岛素。
1.3 胰岛素敏感性的测定 动物空腹采血后恢复2~3天再行葡萄糖-胰岛素耐量实验(G-InsTT)测定大鼠胰岛素敏感性。大鼠于非空腹状态下,腹腔注射2%戊巴比妥钠麻醉,行颈外静脉和股动脉插管,先从静脉注射葡萄糖(700mg/kg),随即注射普通胰岛素(0.175u/kg),从股动脉抽血用葡萄糖氧化酶法,测定实验前及注射胰岛素完毕后第3、6、9、12、15min的血糖值。胰岛素敏感性用K值表示,具体方法为:以时间为横坐标,血糖值经对数转化后为纵坐标,直线回归所得到的回归系数乘以-100即为K值。K值减小表示机体对胰岛素不敏感,即有IR。
1.4 脂肪组织的留取 葡萄糖-胰岛素耐量实验测定后,大鼠断头处死,尽可能留取同一部位股部皮下、附睾周围腹腔脂肪组织,即刻采用上海天平仪器厂生产的微量天平称重。称重后保存在-80℃液氮中。
1.5 脂肪组织中肿瘤坏死因子(TNF-α)、瘦素(leptin)、PPAR-γ基因mRNA水平的测定 取附睾周围腹腔冻存的脂肪组织(0.9g),用TRIzol一步法提取总RNA,经电泳显示28S、18S条带,测定OD260/OD280比值大于1.8。应用RT-PCR法检测脂肪组织中TNF-α、leptin、PPAR-γ基因mRNA表达水平,逆转录酶、Tag酶及缓冲液购自Promega公司,PCR markers由华美生物工程公司提供。引物序列为:TNF-α有义链5′-AGGCGCTCCCCAAAAAGATG-3′,无义链5′-TGGCGGAGAGGAGGCTGACT-3′,扩增产物480bp;Leptin有义链5′-ACCCCAGCGAGGAAAATGTG-3′,无义链5′-GGAAGGCAAGCTGGTGAGGA-3′,扩增产物288bp;PPAR-γ有义链5′-AAGACATCCCGTTCACAAGA-3′,无义链5′-GCTGGTCGATATCACTGGAG-3′,扩增产物459bp;内参照GAPDH有义链5′-TTCATTGACCTCAACTACATG-3′,无义链5′-GTGGCAGTGATGGCATGGAC-3′,扩增产物443bp。由上海博彩生物试剂公司合成。PCR反应体系为25μl,其中包括10×PCR缓冲液2.5μl、25mmol/L MgCl2 1.5μl、10mmol/L dNTPs 0.5μl、引物 2μl、Taq酶2.5μl、cDNA 2μl。循环参数:94℃预变性×1min,58℃退火×1.5min,72℃ 2min,循环35次,最后7次延长至10min,4℃保存。取产物10μl用2%琼脂糖凝胶电泳,60V电泳1h,透射紫外灯下观察结果并拍照。通过电泳图像分析仪进行灰度测量,基因表达水平用TNF-α、leptin、PPAR-γ与GAPDH灰度比值表示。
1.6 脂肪细胞凋亡观察 取液氮中腹腔内附睾周围脂肪组织,在-30℃冰冻切片机中切成8μm薄片,贴在涂有多聚赖氨酸的载玻片上,37℃烤30min,用4%多聚甲醛固定30min,0.01%Triton X-100-PBS洗3×3min,再用0.4%胃蛋白酶消化30min,PBS洗3×3min,加TUNEL混合液,37℃×1h,PBS洗3×3min,甘油封片,荧光显微镜下观察。观察后再PBS洗3×3min,滴加抗FITC二抗(即用液)4℃过夜,PBS洗3×3min,AKP显色30min,核固红衬染,PBS洗3×3min,明胶甘油封片,光学显微镜下观察。采用TUNNEL法,按试剂盒说明的步骤进行染色。阳性细胞计数:在荧光显微镜下计数400倍视野中的阳性细胞数,每个标本共随机观察5个视野,平均数。TUNEL试剂盒由Roche公司生产。
1.7 统计学方法 所有定量指标均以均数±标准差(x±s)表示,实验数据采用SPSS统计软件进行方差分析。
2 结果
2.1 一般指标的改变 实验期间,各组摄食量未见明显差异,高脂饲养2组大鼠大便较正常对照组偏少、较软。高脂饲养2组大鼠体重较正常对照组增高,但均无统计学意义,见表1。
表1 各组大鼠体重的变化 (x±s,g)
2.2 血糖、胰岛素的改变 高脂饲养2组空腹及餐后血糖较正常对照组明显升高(P<0.05)。与高脂对照组相比,药物治疗组血糖有下降趋势,但无统计学意义。高脂饲养2组动物空腹胰岛素水平明显升高,与正常对照组相比差异有显著性(P<0.05),与高脂对照组相比,药物治疗组空腹胰岛素水平明显降低,差异有显著性(P<0.05)。见表2。
表2 各组大鼠血糖、胰岛素、脂肪组织量和K值的改变 (x±s)
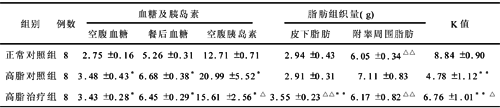
注:与正常对照组相比,*P<0.05,**P<0.01;与高脂对照组相比,△P<0.05,△△P<0.01
2.3 脂肪组织重量的改变 虽然总体重未见明显改变,但高脂饮食组大鼠腹腔脂肪量明显增多,与正常对照组同一部位脂肪量相比差异有非常显著性(P<0.01),而高脂组腹腔脂肪量与正常对照组相比未见明显差异,与高脂饮食组相比明显减少。皮下脂肪量治疗组较高脂饮食组及正常对照组同一部位脂肪量增高明显(P<0.01),但高脂饮食组与正常对照组皮下脂肪量未见明显差异(表2)。
2.4 胰岛素敏感性变化 各组胰岛素敏感性指数K值结果:高脂饲养2组大鼠K值明显低于正常对照组(P<0.01),TZD治疗组K值明显高于高脂对照组(P<0.05)(表2)。
2.5 腹腔内脂肪组织中TNF-α、leptin、PPAR-γ基因mRNA表达 高脂饮食罗格列酮治疗组大鼠与高脂对照组相比,腹腔脂肪组织TNF-α、leptin表达量明显下降(P<0.05),但与正常组相比仍然表达较高(P<0.05)。高脂饮食组与正常组相比则明显升高(P<0.01)。PPAR-γ表达未见改变。见表3。
表3 各组大鼠腹腔内脂肪组织中细胞因子的表达 (x±s)
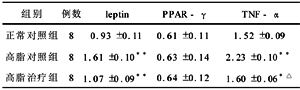
注:与正常对照组相比,**P<0.01,*P<0.05;与高脂对照组相比,△P<0.05
2.6 腹腔脂肪细胞凋亡的观察及计数 在荧光显微镜下观察,染色结果显示TUNEL阳性信号为黄绿色或黄色荧光。每个视野凋亡细胞高脂饲养对照组为(12.24±0.89);正常对照组为(27.12±1.23);罗格列酮治疗组为(26.71±2.29)。高脂治疗组与高脂对照组相比差异有非常显著性(P<0.01),而高脂治疗组与正常对照组之间差异无显著性。
3 讨论
胰岛素抵抗(IR)是指机体对一定量的胰岛素反应性减低的一种病理状态。胰岛素抵抗的过程中,脂肪细胞产生并分泌的TNF-α[3]、leptin[4]、PPAR-γ[5]介导重要作用。在高脂饮食的环境中,不但脂肪细胞过度增殖和分化,脂肪细胞对胰岛素的敏感性也明显下降,这可能是肥胖引起胰岛素抵抗发生的重要因素。已有证明[1],应用罗格列酮治疗可以改善高脂饲养大鼠出现的胰岛素抵抗,但具体机制尚不清楚。我们的研究证实,应用罗格列酮干预治疗高脂饮食大鼠可以使腹腔内脂肪细胞凋亡增加,肿瘤坏死因子及瘦素的表达明显减少。同时发现虽然总体重未见明显改变,但经罗格列酮治疗的大鼠腹腔内脂肪重量明显减少而皮下脂肪量增加。表明大鼠胰岛素敏感性的改善与腹腔内脂肪重量的减少、皮下脂肪重量的增加、脂肪细胞因子的表达及腹腔内脂肪细胞凋亡的增加呈显著相关。因此我们认为罗格列酮改善高脂饲养大鼠胰岛素抵抗的作用机制,可能与罗格列酮可以促使腹腔内具有胰岛素抵抗的脂肪细胞尽快凋亡,从而减少这些脂肪细胞分泌的胰岛素抵抗相关因子的表达,同时也可以加快皮下具有胰岛素敏感的新的脂肪细胞的生成。这样尽管总体重未见明显改变,但脂肪组织对于胰岛素的敏感性却大大提高从而改善胰岛素抵抗。罗格列酮促进脂肪细胞的分化可能是通过PPAR-γ来起作用,本研究发现,无论是高脂饲养还是正常对照组,无论是否应用干预治疗,PPAR-γ的表达量未见明显差异,而其所引起的脂肪细胞分化及细胞因子,如肿瘤坏死因子、瘦素的表达量却有明显不同,说明PPAR-γ的活性与其表达量无关,而其是否磷酸化才是决定其活性的根本所在。然而,罗格列酮引起脂肪细胞凋亡的机制尚有待进一步研究。
【文献】
1 Sidell RJ,Cole MA,Draper NJ,et al.Thiazolidinedione treatment normalizes insulin resistance and ischemic injury in the zucker fatty rat heart.Diabetes,2002,51(4):1110-1117.
2 Hartman HB,Hu X,Tyler KX,et al.Mechanisms regulating adipocyte expression of resistin.J Biol Chem,2002,277(22):19754-19761.
3 Van HV,Dicker A,Ryden M,et al.Increased lipolysis and decreased leptin production by human omental as compared with subcutaneous preadipocytes.Diabetes,2002,51(7):2029-2036.
4 Ebihara K,Ogawa Y,Masuzaki H.Transgenic overexpression of leptin rescues insulin resistance and diabetes in a mouse model of lipoatrophic diabetes.Diabetes,2001,50:1440-1448.
5 Albrektsen T,Frederiksen KS,Holmes WE,et al.Novel genes regulated by the insulin sensitizer rosiglitazone during adipocyte differentiation.Diabetes,2002,51(4):1042-1051.











