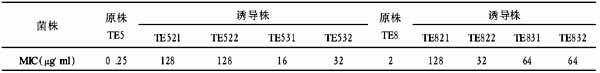
从四种生物原料中制备高纯度I型胶原的比较
作者:保毅, 胡蕴玉,毕龙, 孟国林,李丹,白雪东,刘民
【摘要】 [目的]比较从4种生物原料中制备高纯度I型胶原,以满足骨组织工程应用的需要。[方法]分别以牛皮质骨、牛跟腱、猪跟腱和猪皮为原料,采用酸性条件下胃蛋白酶限制性酶解法提取I型胶原,并用紫外吸光度、氨基酸分析、SDS-PAGE电泳进行鉴定,提取率、纯度,同时与Sigma公司产品进行比较。[结果]本法所提胶原的最大紫外光吸收波长为230nm,氨基酸分析、电泳鉴定符合I型胶原特征。牛皮质骨所提胶原纯度最高(96.12%),优于Sigma公司产品,而牛腱胶原提取率最高(75.34%),超过常规方法。[结论]限制性酶解法可以从4种生物原料中制备高纯度、高提取率的I型胶原产品,其中以牛皮质骨胶原最好,具有良好的应用前景。
【关键词】 I型胶原; 组织工程; 制备; 限制性酶解法
[Method]Bovine cortical bone, bovine achilles tendon, porcine achilles tendon and porcine skin were splitted into pieces of 0.2-0.5 mm. After being immersed in glacial acetic acid, they were extracted with pepsin. Then the crude products were dissolved, centrifuged, dialyzed and freeze drying to prepare pure collagen type I. The final products were confirmed by absorbance, amino acid analysis and'SDS-PAGE electrophoresis comparing them with the products of Sigma Company.
[Result]The wave length of maximum absorbance of the final products was 230 nm, and the amino acid analysis and SDS-PAGE electrophoresis confirmed that the final products were collagen type I. The purity of product extracted from bovine cortical bone was the highest (96.12%) and higher than that from Sigma Company. The extraction rate of bovine achilles tendon collagen was the highest (75.34%).
[Conclusion]Collagen type I of higher purity and higher extraction rate can be prepared using a limited enzyme digestion method.And the product from bovine cortical bone is better than the others,which has a promising prospect.
Key words:collagen type I; tissue engineering ; preparation ; limited enzymedigestion method
I型胶原是骨基质中的主要有机成分。随着骨组织工程技术的应用和,胶原在促进细胞粘附和材料表面修饰方面的优势日益突出[1]。据报道,每年因肿瘤、创伤等各种原因所致需要骨移植的患者超过三千万[2]。由于生物骨材料存在来源有限和免疫原性等诸多限制,需要上百万的人工骨移植产品来满足缺口,而其中大部分产品都用胶原作为原料,由此可见,I型胶原的研究和开发具有巨大的价值和社会效益。由于I型胶原的特殊结构,常规化学方法提取效果差、纯度低,难以满足实际需要。本文作者采取酸性条件下胃蛋白酶限制性酶解法,比较从4种生物原料(牛皮质骨、牛跟腱、猪跟腱、猪皮)中制备I型胶原,并与Sigma公司I型胶原样品在生物特性等方面进行了比较。
1材料与方法
1.1 主要试剂和仪器
胃蛋白酶(Amersco公司)、甲醇、氯仿、冰醋酸、NaHCO3、盐酸、NaCI、NaOH (购自西安化学试剂厂)、 I型胶原(Sigma C9879)液氮、氨基酸分析仪(日立L-8800)、紫外分光光度仪(日立U-2001)、电泳仪(Bio-Rad),高速离心机(BeckmanJ25)、冷冻干燥机(ALPHAl-2LD plus)、深低温冰箱(REVCO)、硬组织粉碎机(上海飞龙仪表电器有限公司)、透析膜、次高分子量标准蛋白质(中科院上海生化所)。
1.2 胶原原料准备
取新鲜牛皮质骨、牛跟腱、猪跟腱、猪皮作为原料。牛皮质骨去除软组织、骨膜、松质骨及骨髓,粉碎机粉碎至0.2~0.5 mm大小骨粉,粉碎过程中加入液氮保持温度在4 ℃以下。取10g骨粉双蒸水洗涤,去除杂质,氯仿、甲醇(1∶1)脱脂4h,双蒸水洗涤3次,0.6 mol/L盐酸脱钙48h,双蒸水洗涤3次。牛跟腱、猪跟腱、猪皮去除软组织、脂肪后分别称取10 g,粉碎机粉碎至0.2~0.5 mm大小组织块,后经NaCI浸泡5 min,NaHCO3浸泡30 min,氯仿、甲醇(1∶1)脱脂4 h,双蒸水洗涤3次。
1.3 胶原提取
将骨粉浸于1 mol/L醋酸,按100∶1(骨粉:胃蛋白酶,w/w)比例加入胃蛋白酶抽提,同时将牛跟腱、猪跟腱、猪皮浸于1 mol/L醋酸,按10∶1(w/w)比例加入胃蛋白酶抽提[3]。共抽提3 d,抽提过程在4℃下进行,连续搅拌。抽提后液体,10 000 g离心10 min,去除沉淀,所得上清为胶原粗提液;粗提液中加入NaCI至浓度为10%,即有大量白色沉淀析出,静置30 min;15 000 g离心15 min,弃上清,沉淀为粗提胶原;粗提胶原复溶到0.5 mol/L醋酸中,过滤去除不溶杂质,10倍体积双蒸水半透膜透析24 h,每8 h换水1次;透析后所得即为精制胶原液,冻干机冻干保存。
1.4 胶原鉴定
1.4.1 紫外分光光度计检测胶原吸收峰
取以上4种胶原0.5%溶液,采用日立U-2001型紫外分光光度仪在200 nm~450 nm波长范围内,以10 nm的间距进行扫描,测定样品最大紫外吸收峰的波长。
1.4.2 胶原氨基酸分析
取以上4种胶原样品0.3 g经6 mol/L盐酸水解为游离氨基酸,经日立L-8800氨基酸分析仪离子交换色谱柱分离后,与茚三酮溶液产生颜色反应,再通过分光光度计比色,测定氨基酸含量。所得结果同I型胶原样品(Sigma公司)进行比对分析。
1.4.3 SDS-PAGE电泳检测胶原蛋白分子量
把以上4种胶原配制浓度为1 μg/μl的样品溶液,进行SDS-PAGE电泳。每次上样量15 μl,以次高分子量标准蛋白为Marker,用5%的浓缩胶,8%的分离胶,电压分别为浓缩胶80 V,分离胶140 V,电泳120 min。
1.5 胶原提取率、纯度分析
1.5.1 提取率测定
每次取4种生物原料(牛皮质骨、牛跟腱、猪跟腱、猪皮)各10 g进行胶原提取,测定每次冻干后纯化胶原的质量,重复5次,并通过以下公式计算胶原提取率。
胶原提取率:5次纯化胶原质量之和 5次生物原料质量之和×100%
1.5.2 羟脯氨酸含量测定(Woressner法[4])
标准曲线绘制:称取羟脯氨酸标准品,溶于0.001 mol/L盐酸,按比例稀释成梯度溶液:12.5、25、50、75、100 mg/ml。取2 ml梯度溶液加入1.4%氯胺T溶液1 ml混合,室温下静置20 min,加入18.9%过氯酸溶液1 ml,室温下静置5 min,加入20%对二甲基苯甲醛溶液1 ml,60 ℃加热20 min,冷却后,测定560 nm处吸光度。统计学软件SPSS 10.0分析浓度和吸光度间关系,计算相关公式、相关系数并拟和标准曲线。
取以上4种胶原各0.40 g与6 mol/L盐酸按1∶100(w/v)混合,110 ℃加热水解24 h,水解后除去盐酸,残渣溶于双蒸水制成样品液。重复上述处理测定560 nm吸光度,并根据公式计算样品中羟脯氨酸含量。
1.5.3 纯度计算
根据报道[5],通过下面公式计算胶原纯度。
胶原纯度:羟脯氨酸含量 胶原样品量×100%
1.6 胶原比较
将本实验所制备4种胶原和I型胶原样品(Sigma公司)进行蛋白含量、胶原纯度的比较。
2 结 果
2.1 紫外分光光度计检测胶原吸收峰
经测定4种胶原最大紫外光吸收波长均在230 nm,形成一个较陡峭的峰,符合胶原蛋白特殊吸收峰波长位置,与文献报道的I型胶原特征相符[6]。
2.2 胶原氨基酸分析
氨基酸分析结果显示:所提4种胶原与sigma I型胶原在氨基酸组成上较相似,其中甘氨酸含量在30%左右,脯氨酸含量12%左右,含硫氨基酸(胱氨酸、蛋氨酸)含量较低,不含色氨酸(表1)。表1 胶原氨基酸分析结果
2.3 SDS-PAGE电泳
4种样品SDS-PAGE电泳显示3条明显条带,分子量大约是21.54×10-23 kg(两条)和109.36×10-24 kg (一条)kDa,符合报道的I型胶原蛋白分子2条αl(Ⅰ)链和1条α2(Ⅰ)链的组成特征。
2.4 提取率测定
本实验所提4种I型胶原样本的蛋白提取率,其中牛腱的提取率最高 (75.34%),猪腱、猪皮的提取率其次,骨粉的提取率最低(6.24%)(表2)。表2 四种胶原的蛋白提取率
2.5 羟脯氨酸标准曲线的绘制(图1)
羟脯氨酸标准曲线,其线性回归方程为A=0.0081p+0.3233,相关系数R2=0.9485。说明该曲线的羟脯氨酸浓度和吸光度相关性好。
图1 羟脯氨酸标准曲线
2.6 纯度
根据测出的羟脯氨酸含量计算的四种I型胶原样本的纯度结果见表3,其结果显示经牛皮质骨所提胶原的纯度最高(96.12%),其次为牛腱(87.50%),而猪皮所提胶原含量则较低(76.25%)。表3 胶原纯度
3 讨 论
组织工程的得益于种子细胞、细胞因子和支架材料各方面的全面发展。而在骨组织工程的各个方面I型胶原都展现出其独特优点[7]。 I型胶原作为骨基质中含量最多的天然大分子物质,与骨的天然结构最接近,同时其种属特异性不强、抗原性低、亲水性好、生物相容性好等优点都使它在人工合成支架材料的改性[8]、细胞三维培养、细胞因子载药微球以及缓释技术等方面有着广泛的应用[9]。文献报道胶原在骨组织工程特别是人工骨组织工程方面应用较多的是表面修饰和改性作用:种子细胞对支架材料的粘附主要是通过细胞表面特异性整合素受体与材料中相应的配体结合而实现,单纯聚酯材料或无机支架缺乏此类配体,难以实现种子细胞的有效粘附;而I型胶原含有的特异性高效识别RGD(精氨酸-甘氨酸-天冬氨酸)肽序列恰恰具有整合素配体的特点,因而用其修饰能够增加细胞对支架材料的粘附,促进细胞的增殖和分化。
I型胶原制备的方法常规分为两大类。一类是利用基因重组合技术人工合成胶原,此类方法可以得到较高纯度的胶原产品,重复性好且质量稳定,但其成本高,工艺复杂,不利于推广。另一类是利用酸、碱、盐等化学物质从天然组织中提取胶原,此类方法工艺简便,成本低,但成分不均一,可重复性差。而且传统酸法或中性盐法所提胶原均为不完全交联的胶原[10],其仅占组织中胶原总量的极少部分,而组织中含量巨大的交联胶原,由于溶解性差不能被有效提取。文献报道交联胶原的不溶性主要是由于胶原两端非胶原特异性结构域端肽的交联,而这些非特异性结构域易于被一些非特异性的酶 (如胃蛋白酶)所降解。基于以上原理,本实验采用限制性酶解法进行胶原制备:即使用胃蛋白酶降解胶原两端的结构域端肽,促进胶原溶解,实现高纯度、高效率的制备,同时此酶又不会破坏胶原的核心结构域([α1(Ⅰ)]2α2(Ⅰ)三链结构),确保了胶原的生物活性[11]。通过SDS-PAGE电泳、氨基酸含量分析和紫外最大吸收光波长证明本方法所制备的I型胶原性质符合文献报道,纯度高于Sigma公司产品。
本法所提胶原提取率的计算中,由于牛皮质骨中含有大量钙,其提取过程中需要脱除骨中钙质,所以牛皮质骨胶原提取率低于其他三种,但所获胶原纯度(96.12%)则明显高于其他,作为原材料大批量生产时,牛皮质骨成本明显低于其他几种、且容易获得,因此其相对较低的提取率是可以接受的。关于胶原纯度的计算,根据文献报道的羟脯氨酸不存在于普通蛋白中,仅存在于胶原、弹性蛋白及伸展蛋白中[12],且在胶原蛋白中的含量为10%,因而可以通过羟脯氨酸含量的测定来计算胶原纯度。
综上所述,本研究采用限制性酶解法对4种生物原料进行胶原提取,通过该方法可以从牛皮质骨中获得高纯度的I型胶原,而从牛跟腱中提取胶原则可以获得较高的提取率。本实验的方法利于胶原批量产品开发,为组织工程及其他胶原相关产品的进一步深入研究、应用及开发提供了有力的实验研究基础。
【文献】
[1] Gelse K,Poschl E, Aigner T. Collagens-strucure, function,and biosynthesis. Advanced Drug Delivery Reviews, 2003,12:1531 - 1546.
[2] 田 丰,成国祥,刘长军,等.骨组织损伤修复生物医用材料的研究进展[J].医疗卫生装备, 2005,2:22-23.
[3] 徐俊华,王慧明.牛肌腱胶原蛋白的提取及多孔支架的制作[J].口腔种植学杂志,2005,3:108-110.
[4] Gogiel T, Bielecki DA, Bankowski E. Collagenous constituents of amniotic fluid[J].Acta Biochim Poi,1998,4:1037-1046.
[5] 赵苍碧,黄玉东,李艳辉.从牛腱中提取胶原蛋白的研究[J].哈尔滨大学学报,2004,4:515-519.
[6] Nagal T, Suzukin. Preparation and partial characterization of collagen from paper nautilus(Argonauta argo, Linnaeus)outer skin[J]. Food Chemistry,2002,76:149-153.
[7] 陈大福,田 伟,行勇列,等.胶原支架增强自固化磷酸钙水泥的力学及成骨性能研究[J].中国矫形外科杂志,2006,18:1410-1412.
[8] 庞 龙,胡蕴玉,颜永年,等.骨组织工程快速成型支架改性的相关研究[J].中华创伤骨科杂志,2007,8:730-734.
[9] Friess W. Collagen-biomaterial for drug delivery[J]. European Journal of Pharmaceutics and Biopharmaceutics 1998,45:113-136.
[10]Kittiphattanabawon P, Benjakul S, Visessanguan W, et al. M. Characterisation of acid-soluble collagen fromskin and bone of big snapper (Priacanthus tayenus)[J]. Food Chemistry, 2005,89:363 - 372.
[11]Deyl Z, Miksik I, Eckhardt A. Preparative procedures and purity assessment of collagen proteins[J]. Journal of Chromatography B,2003,790, 1-2: 245-275.
[12]Mizuta S, Miyagi T, Nishimiya T,et al. Partial characterization of collagen in mantle and adductor of pearl oyster (Pinctada fucata)[J]. Food Chemistry, 2002,79:319 - 325.