体外循环对患者肺内致炎与抗炎物质的影响
来源:岁月联盟
时间:2010-07-13
作者:徐康清 张劲军 黄文起 陈秉学 黄伟明 孙培吾
【摘要】 目的 研究心肺转流(CPB)对心脏手术患者肺内致炎与抗炎物质的影响。方法 择期心脏瓣膜置换患者20例,在CPB前,主动脉开放心脏复跳1、3、5、10 min分别采右心房与肺静脉血检测中性粒细胞(PMN)数量、中性粒细胞黏附分子(CD11b)、丙二醛(MDA)、白细胞介素-10(IL-10)水平及过氧化物歧化酶(SOD)活性水平。结果 与CPB前比较,主动脉开放心脏复跳后各时点,患者肺静脉血中PMN的数目,CD11b的表达,MDA的含量,SOD活性和IL-10水平均显著性增加(P<0.05),差异有统计学意义。与右心房比较,心脏复跳后各时点患者肺静脉血中PMN的数目和CD11b的表达明显增加,MDA的含量、SOD活性和IL-10水平在心脏复跳1、3 min后显著升高(P<0.05),差异均有统计学意义。结论 体外循环过程中肺内致炎性物质增多,引起抗炎性物质的产生亦随之增加,有利于消除炎性反应对肺的伤害。?【关键词】心肺转流术;致炎因子;抗炎因子;肺
??
Effects of lung inflammation media on patients during cardiopulmonary bypass
?
【Abstract】 Objective To study the effects lung inflammation media on patients during cardiopulmonarybypass.Methods Twenty patients,scheduled for elective cardiac valvular replacement were under study.Blood samples from pulmonary vein and right atrium were collected simultaneously before CPB,at aortic unclamping 1,3,5 and 10 min to determine the levels ofPMN,CD11b,MDA,SOD and IL-10.Results After aortic unclamping,levels of the above substances in pulmonary vein were significantly higher than those ofpre-CPB andPMN,CD11b in pulmonary vein were obviously higher than those in right atrium(P<0.05).At aortic unclamping 1,3 min,levels ofIL-10,MDA and SOD from pulmonary vein significantly increased by comparision withsubstances from right atrium(P<0.05).Conclusion Lung inflammatory response mediated by CPB occurred,both inflammatory media and anti-inflammatory media were overproduced and set free.Inflammatory media led to lung injury while anti-inflammatory media could protect respiratory function.?
【Key words】Cardiopulmonary bypass;Inflammatory media;Anti-inflammatory media;Lung
?
心肺转流术后由于手术创伤,尤其经过体外循环,血液与体外循环管道的接触以及停止循环后的缺血再灌注损伤可引起复杂的全身炎性反应(systemic inflammatory response,SIR),严重者可引起死亡。体外循环诱发肺的炎性反应是机体广泛的炎性反应在肺脏局部的作用,它是一种非感染性的炎性反应[1]。目前认为,炎性反应包括促炎与抗类两个方面,本文以肺为研究对象,从细胞分子生物学角度探讨CPB对肺内致炎与抗炎物质的影响。?
1 材料与方法?
1.1 病例选择和麻醉方法 择期心脏瓣膜置换患者20例,ASA II~III级,所有患者无肝肾功能异常,无呼吸道炎性反应。术前用药为吗啡4~5 mg术前半小时肌内注射。麻醉诱导用异丙酚2 mg/kg、芬太尼5 μg/kg、维库溴铵0.1 mg/kg。诱导插管后芬太尼15 μg/kg和异丙酚3~4 mg/(kg•h)分别静脉泵注(Graseby3500微电脑泵),吸入异氟醚维持麻醉,纯氧控制呼吸,维库溴铵间断静脉注射维持肌松。应用Stockert SC 体外循环机及膜式氧合器进行中度低温心肺转流术,心肌保护采用间断正向(经主动脉根部)灌注低温高钾心肌停跳液。肝素用于CPB期间的抗凝,CPB结束时用鱼精蛋白拮抗。患者术后入ICU进行监护。循环稳定,自主呼吸恢复良好则停呼吸机,抽血气如无异常可拔气管导管。?
1.2 标本采集及检测 主动脉开放前约1 min持续膨肺,在主动脉开放前即刻,取右上肺静脉血和右心房血(氧合器内未氧合血,以下同);主动脉开放后心脏复跳1、3、5、10 min分别取右上肺静脉血和右心房血。用美国产贝克曼库尔特流式细胞计数仪测定中性粒细胞整合数(CD11b)平均荧光强度和中性粒细胞(PMN)数量;采用ELISA法测定白细胞介素-8(IL-8)和白细胞介素-10(IL-10)水平;硫代巴比妥酸比色法测定丙二醛(MDA)含量及黄嘌呤氧化酶法测定过氧化物歧化酶(SOD)活性。由于血液稀释的影响,用公式矫正值=实测值×转机前血球压积(HCT)值/实际HCT值对PMN、CD11b、IL-10、MDA、SOD的数值进行矫正。?
1.3 统计学方法 应用SPSS 10.0统计软件,采用方差分析,P<0.05表示差异有统计学意义。?
2 结果?
2.1 所有患者手术顺利并安全渡过ICU监护期,其中患者年龄为(45.7±11.8)岁,CPB时间为(70.28±10.74)min,肺缺血时间为(41.72±8.92)min。?
2.2 与CPB前比较,主动脉开放心脏复跳后各时点,患者肺静脉血中PMN的数目,CD11b的表达,MDA的含量,SOD和IL-10水平分别显著性增加(P<0.05),差异有统计学意义。与右心房比较,心脏复跳后各时点患者肺静脉血中PMN的数目和CD11b的表达明显增加,MDA的含量,SOD和IL-10水平在心脏复跳1、3 min后显著升高(P<0.05),差异均有统计学意义(见表1~3)。?
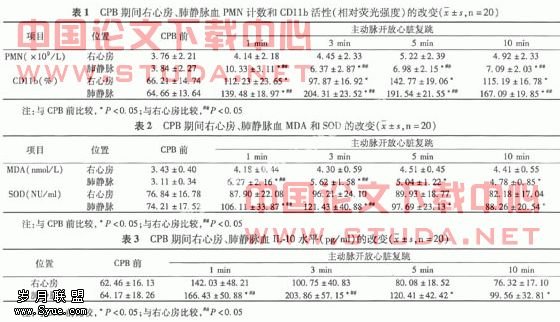
3 讨论?
体外循环可引起机体广泛的炎性反应,肺脏总有大量的PMN聚集,聚集的PMN一方面机械性堵塞毛细血管致微循环障碍,另一方面释放大量的炎性介质。这主要是由于血液与非生理物质接触,肺再灌注引起肺内白细胞隔离,被激活后释放大量炎性介质和氧自由基,而炎性介质和氧自由基对机体重要脏器如心肺等可造成严重的危害[1]。?
国外近年研究表明:体外循环时全身炎性反应所致的白细胞-内皮细胞粘附反应是引起组织损伤的重要起始步骤,调节PMN-内皮细胞粘附反应的粘附分子目前发现有三类,细胞间黏附分子(CD11b),被认为是内皮细胞激活所表达的主要黏附分子[2]。?
经过研究,笔者发现与右心房血比较,CPB缺血再灌注后肺静脉血PMN的数目急剧升高,促炎性物质CD11b的活性和氧自由基MDA的生成显著增多,而且抗炎性细胞因子IL-10和氧自由基清除剂SOD的释放亦相应随之明显增加。这表明肺脏发生炎性反应,产生了大量的炎性物质和抗炎性物质。这可能是由于主动脉开放后,肺组织的再灌注损伤促进了PMN的活化,PMN表面CD11b被激活而表达水平上调,促使PMN快速粘附于内皮细胞并增加PMN与内皮细胞的粘附性,激活促炎性物质的释放,此粘附作用系炎性反应的必然过程,提示CPB中肺脏确实发生了炎性反应。?
MDA是氧自由基致脂质过氧化的中间代谢产物,氧自由基不能及时清除,从而损伤毛细血管内皮细胞和肺泡上皮细胞,导致肺渗出和水肿,从而造成肺损伤[3-4]。自由基的增加可直接诱导并加速促炎性反应物质的转录、复制、合成[5],还可加速炎性反应细胞因子的释放[6-8],形成恶性循环和放大效应。缺血再灌注开始后,肺静脉血中MDA含量和SOD活性明显增高(P<0.05),提示再灌注后,肺静脉血的SOD活性明显升高才能有效地清除氧自由基,使肺避免炎性物质的伤害。?
细胞因子包括IL-6、IL-8、IL-10等,IL-10是近年来发现的一种抗炎性白细胞介素,可调节多种细胞的功能,IL-10通过抑制其他细胞因子的生成达到保护作用,它与其他细胞因子的平衡关系决定炎性反应的程度和临床结果,转流后缺血再灌注、补体激活以及细胞因子之间的相互作用都可以使细胞因子释放[8]。在转流后本试验中肺静脉血IL-10浓度开始上升,主动脉开放后升高显著,于肺再灌注后3 min达高峰,随着主动脉开放后血流的冲刷,其浓度被稀释虽随之下降,但较CPB前仍高(P<0.05),差异有统计学意义。表明IL-10的上调有利于阻断促炎性反应物质和自由基之间的恶性循环及连锁反应,减少肺损伤。?
[1] Markus Rothenburger,Tonny D.T.Tjan,Michael Schneider,et al.The impact of the pro-and anti-inflammatory immune response on ventilation time after cardiac surgery.Cytometry, 2003,53(1):70-74.?
[2] 李晓红,黄元云.体外循环后肺损伤和肺保护的研究进展.体外循环杂志,2008,6(1):58.?
[3] Shinji Hirai. Systemic inflammatory responsesyndrome after cardiac surgery under cardiopulmonary bypass.AnnThoracCardiovascSurg,2003,9:365-370.?
[4] 周海洋,常业恬,吕志平,等.沐舒坦对瓣膜置换患者血浆细胞因子和丙二醛、超氧化物歧化酶的影响.临床麻醉学杂志,2004,20(12):710.?
[5] 王喆妍,骆璇,王东进,等.乌司他丁对术中单肺通气患者氧自由基、促炎性细胞因子的影响.医学,2007,65(6):477.?
[6] 李叙,范士志,李志平,等.体外循环围手术期白细胞、中性粒细胞与细胞因子变化关系研究.重庆医学,2005,34(8):1167.?
[7] Halter J,Steinberg J,Fink G,et al.Evidence of systemic cytokine release in patients undergoing cardiopulmonary bypass.J Extra Corpor Technol,2005,37(3):272-277.?
[8] Li S,Price R,Phiroz D,et al.Systemic inflammatoryresponse during cardiopulmonary bypass and strategies.ExtraCorporTechnol,2005,37(2):180-188.?











