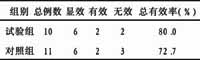
肿瘤坏死因子与脑缺血
作者:杨延林 武继彪 隋在云
【关键词】 肿瘤坏死因子 脑缺血 炎症反应
肿瘤坏死因子(TNF?α)是一种具有广泛生物学功能的多肽类细胞因子。主要是由激活的单核巨噬细胞分泌产生的细胞因子, T细胞、B细胞、血管内皮细胞、星形胶质细胞、小胶质细胞及神经元等也是其分泌细胞[1]。正常情况下,它具有抗肿瘤、抗感染和促进组织修复等重要作用,对机体有利。若持续释放,则会引起机体发热、休克、恶病质和组织损伤。它不仅介导抗肿瘤及调节机体的免疫功能,是一种重要的免疫细胞因子,又是一种重要的炎性细胞因子,在感染性疾病中具有重要的病理生理作用[2]。
1 TNF?α的生物学特点
TNF?α主要由活化单核巨噬细胞产生,又称恶液质素(cachectin)。TNF?α主要是由巨噬细胞、单核细胞产生的多肽类细胞因子,人类成熟后的TNF为157个氨基酸,分子量为17KD,在活化的巨噬细胞内以膜结合型存在并多以旁分泌或自分泌释放,脂多糖(LPS)是诱导其产生的强效刺激剂。TNF发挥生物学效应必须先与靶细胞上的TNF受体(TNF?R)相结合,TNF?α有两种受体TNF?αR?P55(TNFR1)和TNF?αR?P57(TNFR2)。TNF R1控制TNF?α介导的细胞黏附到内皮细胞,调节控制核转录因子?κB活性及细胞间黏附分子?1(ICAM?1)、E选择素和血管细胞黏附分子?1(VCAM?1)的表达。TNF?α浓度很低时,TNF?R2通过结合TNF?α起捕获剂作用,将TNF?α传递给R1,因为R1对TNF?α结合力很低。循环中的可溶性受体对机体产生的TNF?α有一定缓冲能力。TNF?R存在于多种细胞,如淋巴细胞、多形核白细胞、内皮细胞、成纤维细胞、胶质细胞、神经元等。TNF产生后在血液中的半衰期在人类约为14~20min,主要在肝肾降解,但它可在其他组织停留更长的时间。依动物种属及分离方法不同,可以以二聚体或三聚体的形式存在。小鼠和人的TNF?α分别由其前体分子在N端脱去76和79个氨基酸而成,这一过程由金属酶催化,酶抑制剂对一些与TNF?α有关的疾病具有价值[3]。
2 TNFα生物学效应
TNF?α具有双重性、多样性及性生物学效应,是神经?内分泌?免疫调节系统中的关键介质,在多种病理过程中异常表达并发挥重要作用。其生物活性表达主要经过三方面的作用来完成[4]:①对血管内皮细胞作用后影响血管的通透性。TNF既可诱导血管内皮细胞产生凝血活性,引发PAF、TXA、VⅢ、VW因子的增加,还可抑制内皮细胞对抗凝血蛋白C旁路辅助因子的活性,从而使内皮细胞表面成为促凝状态,最终引发血栓和出血的发生。②影响ICAM?1的生成和表达,经ICAM?1调节引起血管的炎性反应,可诱使炎性细胞从血管内向神经组织移行。③影响血管舒缩活性物质的表达,使PGI2、TXB2、ET的产生增加,血管舒缩因子下降,引发血管收缩,增加局部卒中的危险性。
3 TNF?α与脑缺血
脑缺血的病理生理机制很复杂,其中脑细胞能量代谢障碍与代谢性酸中毒、炎症反应及自由基损伤是其重要的损伤机制。本文主要概述炎症反应的损伤机制。脑缺血的炎症反应是由细胞因子介导的,其中TNF?α又是细胞因子中的一种,它不仅对肿瘤细胞有细胞毒性和生长抑制作用,且能介导白细胞介素?1(IL?1)、白细胞介素?6(IL?6)、前列腺素E2等多种炎症介质的产生,参与机体的病理生理过程[5]。TNF?α可以通过上调血管内皮细胞和白细胞上的粘附因子(ICAM?1)的表达,加速活化的淋巴细胞进入脑内,加剧脑内炎症反应;血液中的白细胞(主要是中性粒细胞)与血管内皮细胞之间的粘附作用加强,白细胞粘附于微血管表面,可机械性地堵塞微循环通道,影响组织(特别是缺血半影区)的血液供应,而且活化的白细胞可释放大量的毒性氧自由基蛋白水解酶,损伤局部血管,导致血管通透性增加,造成脑水肿。活化的白细胞透过受损的血管壁向缺血区内移行,可进一步释放上述毒性物质,破坏幸存的神经元和胶质细胞,从而加重神经组织的损伤。
脑缺血时TNF?α增加,还伴有前列腺素(PGI2)、TXB2产生等增加。这些因子除影响血凝过程外,还可促成血管舒缩因子的下降和内皮素(ET)的增加引发血管收缩,增加局部卒中的危险性。脑缺血后2~3天,TNF?α刺激成纤维细胞、成胶质细胞和星形细胞表达神经生长因子,有助于缺血改善和神经元生存。
脑缺血时,在TNF等因子的作用下,血管周围节段性巨噬细胞沉积和内皮细胞通透性改变随年龄推移而加重,在遇到诸如凝集状态变化、紧张、感染和创伤等因素时,最终导致该部位梗塞的发生。在短暂性脑缺血早期,小胶质细胞产生的TNF?α,免疫反应强度在1.5小时达高峰,6小时开始下降,尽管有胶质细胞的持续存在,但细胞因子水平很快下降。晚期(1~3天)星形胶质细胞也产生TNF?α,可能是晚期的TNF表达导致了短暂性脑缺血后脑神经细胞的死亡[6]。实验证实,大鼠局灶性脑缺血后3~6小时神经元表达TNF?α,12小时后出现中性粒细胞浸润;给正常大鼠皮质注射TNF?α后,24小时内局部毛细血管中大量白细胞附壁,很多已侵入内皮下层,提示TNF?α可诱导炎性细胞在急性期从外周侵入缺血损伤组织[7]。实验还发现[8],大鼠脑缺血前24小时腹腔注射TNF?α,可明显加重脑缺血损伤,注射前0.5小时应用抗TNF?α单克隆抗体(TNF?αmAb)则显著消除上述作用;缺血前0.5小时及缺血后3~6小时内单独注射TNF?αmAb也能减轻脑损伤。提示外源性和内源性TNF?α均可在脑缺血急性期加剧组织损伤。研究还发现TNF?α含量与梗死灶面积及部位均无明显相关性[9]。徐学君等[10]研究发现随着缺血时间的延长,TNF?α表达的增加则可产生损伤性生物学效应。
脑缺血后TNF?α表达增加,TNF?α具有损伤与修复双重作用。它对脑组织的损伤包括激活多形核白细胞(PMN)、增加细胞间粘附分子的表达及促进IL?1、IL?6与粒?单核细胞集落因子释放引起的炎症反应,损伤血脑屏障及促进微血管内血栓形成[11]。还有研究表明,TNF?α导致包括神经元在内的一些细胞产生超氧化物歧化酶(SOD),保护神经元免遭反应性氧介质的损害[6]。实验观察,TNF?α,参与了耐受诱导机制。闭塞大脑中动脉前48小时,脑池内给予合成的小鼠TNF?α可以减小局灶性脑缺血梗死面积,因为在缺血耐受动物梗死区白细胞数降低,CD11免疫反应性下降,提示可能是池内注射TNF?α获得耐受的机制[12]。此外,TNF?α还可激活神经生长因子在不同细胞的表达增加,其中包括纤维母细胞、胶质细胞和星形细胞等均可出现这种改变,有助于缺血改善及神经元生存。缺血后7~30天通过巨噬细胞和胶质细胞产生丝氨酸激酶、蛋白激酶C、酪氨酸激酶、超氧阴离子等,限制损伤进展,促进血管生成,参与损伤组织吸收、修复及重塑[13]。
综上所述,TNF?α作为缺血性脑损伤所诱发的初始调节因子,可触发众多反应通路,并根据其来源、靶细胞不同,在不同阶段产生不同甚至相反的综合性效应。脑缺血急性期,TNF?α通过诱发和促进炎症、细胞毒性、凝血等反应及多种凋亡途径加剧损伤;后期则发挥其迟发性免疫抑制、促生长、抗氧化及限制、吸收、重塑等保护性作用。
【】
1 杨金升.肿瘤坏死因子在脑卒中时的表达及作用.国外医学脑血管疾病分册,1996,4:77
2 包兴吕.肿瘤坏死因子与脑缺血.健康,2000,10 :4
3 李建兵,张 静,吴纯慧.肿瘤坏死因子TNF?α与缺血性脑血管病相关性研究进展.淮海医药,2005,23(1):86
4 刘 立.局灶性脑缺血早期过程中的炎症及其损伤作用.国外医学脑血管疾病分册,1996, 4(1):3
5 刘孟元.细胞因子在神经内分泌免疫调节中的作用.国外医学免疫学分册,1993,6(5):239
6 Unoh,Matsuyama T,Akita H,et al.Induction of tumor necrosis factora in the mouse hippocampus following transient forebrain ischemia.J cereb blood flow metab,1997,17(5):491?499
7 Liu T,Clark PK,Medonnell PC,et al.Tumor necrosis factor alpha expression in ischemic neurons.Stroke,1994,25(7):1481?148
8 Barone F,et al.Tumor necrosis factor?alpha,A mediator of focal ischemic brain injury.Stroke,1997,28(6):1233?1244
9 曹 音,强丽娟,吴秀梅.急性脑梗塞患者血浆肿瘤坏死因子?α含量的变化.航天医药杂志,2002,4(1):17
10 徐学君,游 潮,高晋见,等. TNF?α在脑缺血再灌注损伤中的表达及意义.四川医学,2006,27(7):670?672
11 谢立新.脑缺血损伤的炎症机制研究进展.现代医药卫生,2004,20(7):516
12 Nawashiro H, et al. TNF?α pretreatment induces protective effects against focal cerebral ischmia in mice. J Cereb Blood Flow Metab,1997,17(5):483?490
13 刘 辉.肿瘤坏死因子?α与缺血性脑损伤.国外医学脑血管疾病分册,1998,(5):263?266